
1. 化学健:离子键、共价键(极性、非极性)、金属键各种键型的特征、成键粒子。
区分离子化合物和共价化合物的根本是看熔融态能否导电。
16.特征网络:
(1)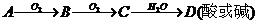
①
②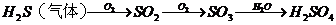
③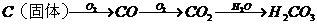
④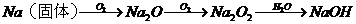
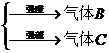 (2)A-
(2)A-
A为弱酸的铵盐:(NH4)2CO3或NH4HCO3;(NH4)2S或NH4HS;(NH4)2SO3或NH4HSO3
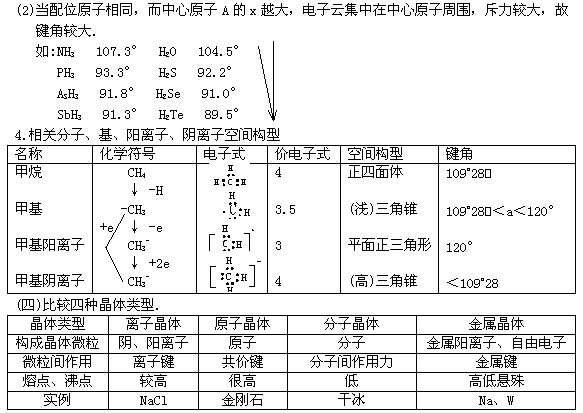
(3)无机框图中常用到催化剂的反应:

 三十四 -- 分子极性 物质熔、沸点比较
三十四 -- 分子极性 物质熔、沸点比较
15.受热分解产生2种或3种气体的反应:

(1)铵盐

(2)硝酸盐
14.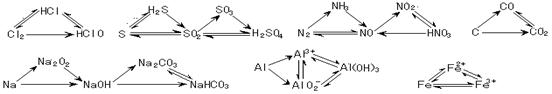 三角转化:
三角转化:
13、一些特殊的反应类型:
 ⑴、 化合物+单质
化合物+化合物 如:
⑴、 化合物+单质
化合物+化合物 如:
Cl2+H2O、H2S+O2、、NH3+O2、CH4+O2、Cl2+FeBr2
 ⑵ 、化合物+化合物
化合物+单质
⑵ 、化合物+化合物
化合物+单质
NH3+NO、 H2S+SO2 、Na2O2+H2O、NaH+H2O、Na2O2+CO2、CO+H2O
 ⑶、
化合物+单质
化合物
⑶、
化合物+单质
化合物
PCl3+Cl2 、Na2SO3+O2 、FeCl3+Fe 、FeCl2+Cl2、CO+O2、Na2O+O2
12.置换反应:
(1)、金属(还原性)置换金属:
①、金属与盐溶液的反应:按金属活动顺序表金属(熔融液例外:KCl+Na △NaCl + K
是利用沸点K<Na )
②、金属与氧化物反应:铝热反应、炼钢中的脱氧反应(Mn+ FeO高温Fe+ MnO)
(2)、金属(还原性)置换非金属
①、金属与酸(有机-COOH或无机)溶液反应:按金属活动顺序
②、金属与水反应:
③、金属与氧化物反应:Mg + CO2→
④、金属与醇类反应:Na、Mg、Al等+ROH→
⑤、金属与酚(-OH)类反应:
⑥、金属与酸式盐反应:
(3)、非金属置换非金属
①、非金属(氧化性)与盐溶液的反应:按非金属活动顺序表
②、非金属(还原性)与氧化物反应: SiO2+ C→、 C+ H2O→
③、非金属(还原性)与氯化物反应:SiCl4+ H2→
(4)、非金属置换金属
①、氢气(还原性)与金属氧化物反应:
②、单质C(还原性)与金属氧化物反应:
③、单质Si(还原性)与金属氧化物反应: Si+ 2FeO高温2Fe+ SiO2
11.归中反应:2H2S+SO2=3S+2H2O
4NH3+6NO 5N2+6H2O
5N2+6H2O
10. Al3+ Al(OH)3 AlO2-
9.铝热反应:Al+金属氧化物 金属+Al2O3
金属+Al2O3
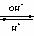
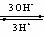
8.电解
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com