
2、利用分析法
[例题1]、 现有浓度各为 1mol/l的FeCl3、FeCl2、CuCl2的混合溶液100ml ,加入一定量的铁粉,按下列情况填空(以回答溶质提供的微粒为主)
(1)、反应完毕,铁粉有剩余:
①、反应完毕,溶液中一定含有阳离子是 ,为 mol;一定没有阳离子是 。
②、固体物质烘干后,其中一定含有 ,与反应前加入的铁粉质量比 (填“少”或“多”) g。
(2)、反应完毕,有铜生成,铁粉无剩余:
①、反应后的溶液一定含有阳离子是 ,该阳离子在溶液中的物质的量范围为 。
②、溶液中可能含有阳离子是 ,该阳离子在溶液中的物质的量可能存在的范围为 。
③、溶液中一定不含有阳离子是 。
④、溶液的质量 (填“增加”或“减少”)。
(3)、反应完毕,无固体沉淀物存在,反应后的溶液中一定含有阳离子是 ,它们中物质的量为定值的阳离子是 ,为 mol;它们中物质的量的为数值范围的阳离子是 ,该数值范围为 。
1、 利用关系法巧做:
[例题1]:(07东城理综练习)在ag氧化铜和氧化铁混合物中,加入2mol·l-1H2SO450ml,恰好完全溶解。若ag该混合物在H2中加热充分反应,冷却后剩余固体质量(g)为
(A)、1.6a (B)、(a-1.6) (C)、(a-3.2) (D)、1.6
[例题2]:(07西城抽测)将mg Fe、Mg合金溶解在足量的稀HNO3中,合金完全溶解时,收集到标准状况下n L气体。再向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为 g。(用相关的字母表示)
[例题3]:(07海淀一模)将11.9 g Mg-Al-Fe组成的合金溶于足量NaOH溶液中,合金质量减少2.7 g 。另取等质量的合金溶于过量的稀硝酸中,生成6.72 L(标准状况)NO,向反应后的溶液中加入适量的NaOH溶液恰好使Mg2+、Al3+、Fe3+完全转化为沉淀,则沉淀的质量为 。
7.注意对“隐藏反应(平衡球实验)”的考查:2NO2(g,红棕色)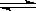 N2O4(g,无色);△H<0。
N2O4(g,无色);△H<0。
热水或冷水中气体颜色的变化,平衡的计算,NA,气体的压强或密度等。
四十-- 有关化学计算:
6.工业合成氨条件的选择
从反应速率和化学平衡两个角度来考虑实际工业生产中合成氨的条件。利用化学反应速率和勒夏特列原理分析:最适宜的条件:催化剂--铁触媒;高温--500℃;高压--20-50MPa )
5.化学平衡的计算
“三行式法”(开始、变化、平衡,注意只有变化量之比才一定等于系数比),转化率的求算,压强、体积、物质的量等的相互关系。
4.化学平衡图像
掌握平衡移动原理,尤其要注意外界条件的改变对一个可逆反应来讲,正逆反应速率如何变化,化学平衡如何移动,在转化率-时间图、反应物的含量-浓度图等上如何体现。要能够画出有关的变化图象。图象三原则:
(1)、看懂图象:一看面(看清横坐标和纵坐标);二看线(看线的走向及变化趋势);三看点(起点、拐点、终点);四看要不要作辅助线;五看图象中有关量的大小
(2)、联系规律:联想外界条件对化学反应速率和化学平衡的影响规律
(3)、作出判断:依题意仔细分析作出正确判断 先拐先平; 定一议二。
3.化学平衡移动原理(勒沙特列原理)。
勒沙特列原理(平衡移动原理):如果改变影响平衡的一个条件(浓度,温度,压强等)平衡就向减弱这种改变的方向移动.
①、浓度:在其它条件不变的情况下,增大反应物的浓度或减小生成物的浓度,平衡向正反应方向移动;反之向逆反应方向移动;
②、压强:在其它条件不变的情况下,增大压强会使平衡向气体体积缩小的方向移动;减小压强平衡向气体体积增大的方向移动;注意:①对于气体体积相同的反应来说,增减压强平衡不移动; ②若平衡混合物都是固体或液体,增减压强平衡也不移动; ③压强变化必须改变了浓度才有可能使平衡移动.
③、温度:在其它条件下,升高温度平衡向吸热方向移动;降低温度平衡向放热方向移动.(温度改变时,平衡一般都要移动)注意:催化剂同等倍数加快或减慢正逆反应的速率,故加入催化剂不影响平衡,但可缩短达到平衡的时间.
④、充入稀有气体对化学平衡的影响:
(1)、恒压下通稀有气体,平衡移动方向相当于直接减压(也同于稀释对溶液中反应的影响);
(2)、恒容下通稀有气体,平衡不移动. 注意:只要与平衡混合物的物质不反应的气体都可称”稀有”
气体
2.化学平衡状态的定义。化学平衡的判定(抓住本质特征:对于同一种物质而言正逆反应速率相等)和特征(等、定、动、变)。
1.化学反应速率的定义和简单计算。影响速率的因素:反应物的性质是内因是主要因素,外因有温度、浓度、压强、催化剂、固体物质颗粒大小等。
3.强酸与弱酸的比较(如何证明一种酸为弱酸?)
(1)物质的量浓度相同、体积相同的盐酸与醋酸的对比
|
|
c(H+) |
pH |
中和碱 的能力 |
与过量Zn的反应情况 |
稀释相同倍数后 的pH变化情况 |
|
|
产生氢 气的量 |
开始时的 反应速率 |
|||||
|
盐酸 |
|
|
|
|
|
|
|
醋酸 |
|
|
|
|
(2)pH相同、体积相同的盐酸与醋酸的对比
|
|
c(H+) |
c(酸) |
中和碱 的能力 |
与过量Zn的反应情况 |
稀释相同倍数后 的pH变化情况 |
|
|
产生氢 气的量 |
开始时的 反应速率 |
|||||
|
盐酸 |
|
|
|
|
|
|
|
醋酸 |
|
|
|
|
三十九-- 化学平衡
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com