
20.(8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯
化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是.
Mg(OH)2(固) 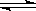 Mg2++2OH- …… ①
Mg2++2OH- …… ①
NH4++H2O 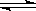 NH3·H2O+H+②
NH3·H2O+H+②
H++OH-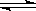 H2O……③
H2O……③
由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;乙同学的解释是.
Mg(OH)2(固) 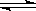 Mg2++2OH-……①
Mg2++2OH-……①
NH4++OH- 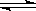 NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位
同学的解释只有一种正确,他选用的试剂是___________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)请你说明丙同学作出该选择的理由_________________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位
同学的解释更合理___________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式_________________。
19.(12分)某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100 mL稀H2SO4溶液;以0.14mol/L的NaOH溶液滴定上述稀H2SO425mL,滴定终止时消耗NaOH溶液15mL。
(1)该学生用标准0.14 mol/L NaOH溶液滴定硫酸的实验操作如下:
A.用酸式滴定管取稀H2SO4 25 mL,注入锥形瓶中,加入指示剂。
B.用待测定的溶液润洗酸式滴定管。
C.用蒸馏水洗干净滴定管。
D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2-3 cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下。
E.检查滴定管是否漏水。
F.另取锥形瓶,再重复操作一次。
G.把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度。
①滴定操作的正确顺序是(用序号填写): 。
②该滴定操作中应选用的指示剂是: 。
③在G操作中如何确定终点?___________________。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”) ,原因是 。
(3)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度<计算出结果到小数点后二位) mol/L
18.向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加等体积水稀释时,都会引起 ( )
A.溶液的pH增大 B.CH3COOH的电离程度增大
C.溶液的导电能力减小 D.溶液的c (OH– )减小
17.已知:101kPa时的辛烷的燃烧热为5518kJ·mol-1,强酸与强碱在稀溶液中发生反应时的中和热 57.3kJ·mol-1,则下列热化学方程式书写正确的是 ( )
①C8H18(l)+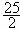 O2(g)
O2(g) 8CO2(g)+9H2O(l);△H=+5518kJ·mol-1
②C8H18(l)+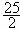 O2(g)
O2(g) 8CO2(g)+9H2O(l);△H=-5518kJ·mol-1
③H++OH- H2O;△H=-57.3kJ·mol-1
④NaOH(aq)+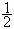 H2SO4(aq)
H2SO4(aq) 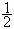 Na2SO4(aq)+H2O(l);△H=+57.3kJ·mol-1
Na2SO4(aq)+H2O(l);△H=+57.3kJ·mol-1
A.①③ B.②③ C.②④ D.只有②
16.2003年10月15日我国成功发射了第一艘载人航天飞船--“神州五号”。发射“神五”时用肼(N2H4)作为火箭发动机的燃料,NO2为氧化剂,反应生成N2和水蒸气。已知:N2(g) + 2O2(g) = 2NO2(g);△H = + 67.7kJ/mol。 N2H4(g) + O2(g) = N2(g) + 2H2O(g);△H = – 534kJ/mol。下列关于肼和NO2反应的热化学方程式中,正确的是 ( )
A.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(l);△H = – 1135.7kJ/mol
B.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1000.3kJ/mol
C.N2H4(g) + NO2(g) = 3/2N2(g) + 2H2O(l);△H = – 1135.7kJ/mol
D.2N2H4(g) + 2NO2(g) = 3N2(g) + 4H2O(g);△H = – 1135.7kJ/mol。
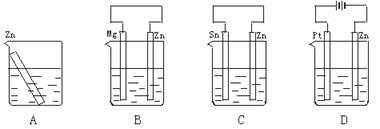
15.分别放置在图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最慢的是
14. 用铂电极电解下列溶液时,阴极和阳极上的主要产物分别为H2和O2的是:
A、稀NaOH溶液 B、HCl溶液 C、酸性MgSO4溶液 D、酸性AgNO3溶液
13.在一个容积为VL的密闭容器中放入2LA(g)和1L B(g),在一定条件下发生下列反应3A(g)十B(g) 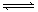 nC(g)+2D(g) 达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是 ( )
nC(g)+2D(g) 达到平衡后,A物质的量浓度减小1/2,混合气体的平均摩尔质量增大1/8,则该反应的化学方程式中n的值是 ( )
A.1 B.2 C.3 D.4
12.下列离子组能够在溶液中大量共存,加入NaOH溶液有沉淀生成,加入稀盐酸有气体放出的是Na+、Ba2+、NO3-、HCO3- ( )
A.Na+ 、Fe2+、Cl- 、SO42- B.K+ 、Ba2+、Cl- 、CO32-
C.NO3- 、Al3+、Cl- 、Ca2+ D.Na+、Ba2+、NO3-、HCO3-
11.应2X(g)+Y(g)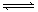 2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和
2Z(g);△H<0(正反应为放热反应)。在不同温度(T1和
T2)及压强(P1和P2)下,产物Z的物质的量[n(Z)]与反应时间(t)的关系如图所示。则下列判断正确的是 ( )
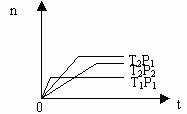
A.T1<T2,P1<P2 B.T1<T2,P1>P2 C.T1>T2,P1>P2 D.T1>T2,P1<P2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com