
1869年2月,俄国化学家门捷列夫将当时已发现的63种元素列成元素周期表,并留下一些空格,预示着这些元素的性质。在元素周期表的指导下,人们“按因索骥”找出了这些元素。
元素种类到底是否有限? 周期表有否终点? 这是科学家们,也是诸位读者所关心的问题。
本世纪30-40年代,人们发现了92号元素,就有人提出92号是否是周期表的最后一种元素。然后从1937年起,人们用人工合成法在近50年时间又合成近20种元素,元素周期尾巴越长了。这时又有人预言,105号元素该是周期表的尽头了,其理由是核电荷越来越大,核内质子数世越来越大,质子间的排斥力
将远远超过核子间作用力,导致它发生蜕变,然而不久,又陆续合成了106-109号元素。这些元素存在的时间很短,如107号元素半衰期只有2微秒,照此计算是否周期表到尽头了?
1969年起,理论物理学家从理论上探索“超重元素”存在的可能性,他们认为具有2,8,14,28,50,82,114,126,184等这些“幻数”的质子和中子,其原子核比较稳定,这就是说,随着原子序数的递增,其原子核不一定不稳定。因此在109号元素之后还能合成一大批元素,这样一来,第七周期32种元素将会被填满,第八周期也将填满(按理论计算,第八周期元素共50种,其中7种主族元素,1种惰性元素,10种过渡元素或副族元素,还有32种超锕系元素,列在周期表下方的锕系下方)。
然而理论的唯一检验标准是实践,能否不断合成新元素至今还是一个谜案,科学家将上天(如到月球)入地(如海底)或反复在粒子加速器中进行实验,企图合成新元素,其结果将会如何,人们正拭目以待。
有趣的是,有些科学家还提出元素周期表还可以向负方向发展,这是由于科学上发现了正电子、负质子(反质子),在其它星球上是否存在由这此些反质子和正电子以及中子组成的反原子呢?这种观点若有一朝被实践证实,周期表当然可以出现核电荷数为负数的反元素,向负向发展也就顺理成章了。
(二)卤族元素
1、卤素原子结构(1)示意图:F Cl Br I 。
最外层电子数相同,但电子层数逐渐增大,得电子能力 ,非金属性 。
2、卤族元素单质的物理性质的变化规律 (随原子序数的递增)
(1)颜色:__色-__色-___色-__色 (颜色逐渐加深 ) (2)状态: _态-_态-_态(3)熔沸点:逐渐__ (4)密度: 逐渐__ (5)水溶解性:逐渐__。
3、卤素单质与氢气反应
|
名称 |
反应条件 |
方程式 |
生成氢化物的稳定性 |
||||
|
F2 |
_____ |
H2+F2====2HF |
HF很稳定 |
||||
|
Cl2 |
_____ |
|
HCl稳定 |
||||
|
Br2 |
_____ |
H2+Br2======2HBr |
HBr较不稳定 |
||||
|
I2 |
_____ |
H2+I2======2HI |
HI___稳定 |
(4)随核电荷数的增加,卤素单质氧化性逐渐减弱:Cl2+_NaBr-______;氟气与氯化钠水溶液反应:____________。
疑难点拨
(一)碱金属元素
1、原子结构
|
|
元素名称 |
核电荷数 |
原子结构示意图 |
最外层电子数 |
电子层数 |
|
碱 金 属 元 素 |
|
|
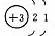 |
|
|
|
|
|
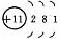 |
|
|
|
|
|
|
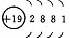 |
|
|
|
|
|
|
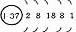 |
|
|
|
|
|
|
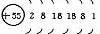 |
|
|
结构异同:异:核电荷数:由_→_;电子层数:由_→_;同:最外层电子数均为_个。单质密度逐渐 ,熔沸点逐渐 。
2、碱金属的化学性质:钾的保存及取用方法: 。
(1)与氧气反应差异性:
Li+O2 _(_色、氧化锂);_Na+O2
_(_色、氧化锂);_Na+O2 __(_色、过氧化钠);_K+O2
__(_色、过氧化钠);_K+O2 _(_色,_氧化钾);_Rb+_O2
_(_色,_氧化钾);_Rb+_O2 _(棕色、_氧化铷);_CS+_O2
_(棕色、_氧化铷);_CS+_O2 _(_色、_氧化铯)。
_(_色、_氧化铯)。
(2)与水反应差异性:(填反应现象)
2Li+2H2O=2LiOH+H2↑(__);2Na+2H2O=2NaOH+H2↑(剧烈);2K+2H2O=2KOH+H2↑(____、__);2Rb+2H2O=2RbOH+H2↑(更猛烈、燃烧、爆炸)。
(3)写出下列反应的化学方程式:
过氧化钾与CO2: ;超氧化钾与水、CO2: 、 ;
氧化锂与水、CO2 : 、 。
2.族:(1)由 构成的族,叫做主族; 构成的族,叫做副族。(2)元素周期表的中部从 族到 族10个纵行,包括了 族和全部副族元素,共六十多种元素,通称为过渡元素。因为这些元素都是 ,所以又把它们叫做过渡金属。(3)主族元素的族序数=元素原子的最外层电子数。周期表共18个纵行( 个主族; 个副族;一个 族;一个 族( 、 、 三个纵行))。
把电子层数目相同各种元素,按 排成横行;再 排成纵行得到一个表,这个表就叫元素周期表。元素周期表是 的具体表现形式,它反映了 相互联系的规律,是我们学习化学的重要工具。
1.周期:(1)周期序数=电子层数, 共
个周期( 、 、 短周期; 、 、 长周期; 不完全周期)。填表:
|
类别 |
周期序数 |
起止元素 |
包括元素种数 |
核外电子层数 |
|
短周期 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
长周期 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
不完全周期 |
|
|
|
|
(2) 总称镧系元素。 ,总称锕系元素。在锕系元素中 以后的各种元素,多数是人工进行核反应制得的元素,这些元素又叫做超铀元素。
45.6 cm Hg.问此时仪器舱内温度为多少?
18、火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热.已知0.4 mol液态肼与足量液态双氧水反应,生成氮气和水蒸气,放出256.652 kJ的热量.
(1)反应的热化学方程式为_____________________.
(2)又已知H2O(l)===H2O(g),ΔH=+44 kJ·mol-1,由16 g液态肼与液态双
氧水反应生成液态水时放出的热量是__________kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是________________________________________.
(4)火箭的密封仪器舱内有一水银气压计,起飞前仪器舱内气温为 17 ℃,气压计中水银柱高度为76 cmHg.当火箭以大小为g的加速度竖直向上发射时,气压计水银柱高度为
17、把煤作为燃料可通过下列两种途径:
途径Ⅰ:C(s)+O2(g) CO2(g) (
放热Q1 kJ )
CO2(g) (
放热Q1 kJ )
途径Ⅱ:先制水煤气
C(s)+H2O(g) == CO(g)+H2(g) (吸热Q2 kJ)
再燃烧水煤气
|
 2CO2(g)
2CO2(g)
2H2(g)+O2(g) 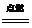 2H2O(g)
2H2O(g)
试回答下列问题:
(1)判断两种途径放热:途径Ⅰ放出的热量_________(填“大于”、“等于”或“小于”)
途径Ⅱ放出的热量。
(2)Q1、Q2、Q3的数学关系式是__________________。
(3)由于制取水煤气反应里,反应物所具有的总能量________生成物所具有的总能量,
那么在化学反应时,反应物就需要_______能量才能转化为生成物,因此其反应条
为 。
(4)简述煤通过途径Ⅱ作为燃料的意义: 。
16.在氢气与氯气反应生成氯化氢气体的反应中,若断裂1mol H - H键要吸收436KJ的能量,断裂1mol Cl- Cl键要吸收243KJ的能量,断裂1molH - Cl键要吸收432KJ的能量,则充分燃烧1mol H2 的能量变化是 。若 ΔH〈 0代表放热,ΔH 〉0代表吸热,该化学反应的热化学方程式是 。
15.不同的物质不仅组成不同、结构不同,所包含的 也不同。放热反应的宏观表现是 ,其微观表现是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com