
3.1836年,俄国化学家盖斯指出:化学反应的热效应仅与反应物的最初状态和生成物的最终状态有关,而与中间步骤无关。按此规律,结合下列热化学方程式:
C(固、金刚石) + O2(气) == CO2(气) ΔH= -395.41 kJ/mol
C(固、石墨) + O2(气) == CO2(气) ΔH= -393.51 kJ/mol
回答有关问题:(1)石墨转化为金刚石的热化学方程式是:(2)石墨和金刚石相比较,__________的稳定性更大。
答案:
2.常温下14克CO在足量氧气中充分燃烧,放出141.3KJ热量,写出该热化学方程式。
化学反应所释放的能量是现代能量的主要来源之一。化学反应一般是以热量和功的形式跟外界环境进行能量交换的,而其中多以热量的形式进行能量交换。
(1)化学反应的特征是有新物质生成,生成物与反应物所具有的总能量不同。
(2)任何化学反应除遵循质量守恒外,同样也都遵循能量守恒。
(3)反应物与生成物的能量差若以热量形式表现即为放热反应或吸热反应。
自我检测:
1.3mol CH4燃烧时,生成液态水和CO2 同时放出2670.9KJ的热。请写出热化学方程式。
2.书写要点: C(固) + H2O(气) = CO(气) + H2(气) ΔH= +131.3 kJ/mol
(1)标集聚状态(固、液、气)
(2)右端标热量数值和符号: 吸热用“+”,放热用:“-”。
(3)系数单位是“摩”,而不是“个”;也不能表示物质的量之比。
(4)系数可用分数,但热量值要相应变化。
如:2H2(气) + O2(气) = 2H2O(液) ΔH= -571.6 kJ/mol
H2(气) + 1/2 O2(气) = H2O(液) ΔH= -285.8 kJ/mol
(5)不注明条件,即指250C 、1.01×105Pa
2.若反应物状态不同,而生成物状态相同,那么热量值相同吗?答:不同
1.为什么集聚状态不同,热量值不同?答:液态水变成水蒸气要吸收热量
1.定义:____________________的化学方程式
例如:H2 (气) + 1/2 O2 (气) = H2O (气) ΔH= -241.8kJ/mol
H2(气) + 1/2 O2(气) = H2O (液) ΔH= -285.8 kJ/mol
讨论:
3.放热反应:放出热量的化学反应。(放热>吸热)ΔH__0;吸热反应:吸收热量的化学反应。(吸热>放热) ΔH__0
2.化学反应中能量变化与反应物和生成物总能量的关系
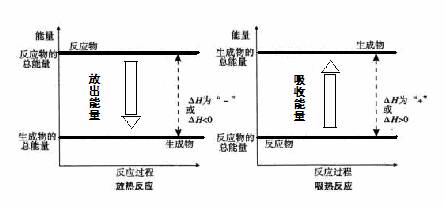
1.定义:化学反应过程中_______的能量都属于反应热,又称为__(ΔH),单
位___。
思考:化学反应中为什么会伴随能量变化?(微观解释)
旧键的断裂:____能量 ;新键的形成:___能量,总能量的变化取决于上述两个过程能量变化的相对大小。吸热:__者>__者;放热:__者<__者。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com