
3、化学反应速率测定方法
例5、经过长期实践,人们总结出反应速率和反应物浓度之间存在定量关系:恒温下,对简单反应来说,化学反应速率同反应物浓度的方次的乘积成正比(反应物浓度的方次等于反应方程式中各物质的化学计量数)。如对于反应mA+nB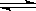 C来说,v=K[c(A)]m[c(B)]n,其中K为常数。
C来说,v=K[c(A)]m[c(B)]n,其中K为常数。
今有一反应,aA+bB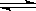 C,在25℃时,将A、B溶液按不同浓度混合,得到下列实验数据:(见下表)
C,在25℃时,将A、B溶液按不同浓度混合,得到下列实验数据:(见下表)
|
A的浓度(mol/L) |
B的浓度(mol/L) |
C的浓度(mol/L) |
|
1.0 |
1.0 |
1.2×10-2 |
|
1.0 |
4.0 |
1.92×10-1 |
|
4.0 |
1.0 |
4.8×10-2 |
分析以上数据,求a、b的值。
解析:这是一道信息迁移题,目的考查学生处理信息的能力。题中给出化学反应速率同反应物浓度的关系式,并给出同一温度下不同反应物浓度浓度时反应速率的三组数据,要求出a、b只要把每组数据代入关系式,求出每一个量,利用求出的数据作为已知再求出其他数据,或通过比较求得a、b的值。
0.8>0.5>0.4>0.35,故④情况下反应速率最快.本题答案:D。
(3)根据“同一反应中各物质的反应速率之比等于化学方程式中各物质的系数之比”间接计算或确立各化学反应速率的关系。
例3、已知:4NH3+5O2 4NO+6H2O,若反应速率分别用V(NH3)、V(O2 )、V(NO)、V(H2O)[mol·L-1·min-1]表示,则关系正确的是
4NO+6H2O,若反应速率分别用V(NH3)、V(O2 )、V(NO)、V(H2O)[mol·L-1·min-1]表示,则关系正确的是
A、4V(NH3)=5V(O2) B、5V(O2)=6V(H2O)
C、3V(NH2)=2V(H2O) D、4V(O2)=5V(NO)
解析:化学反应方程式的系数与分别用各物质表达的化学反应速率成正比。答案:C、D
(4)利用“同一反应中各物质的反应速率之比等于化学方程式中各物质的系数之比”确立方程式系数,进而确立反应的反应式。
例4、某温度时,浓度都是1mol·L-1的两种气体,X2、Y2在密闭容器中反应生成气体Z,达到平衡时[X2]=0.4mol·L-1、[Y2]=0.8mol·L-1、[Z]=0.4mol·L-1,则该反应的反应式是
A、X2+2Y2
 2XY2 B、2X2+Y2
2XY2 B、2X2+Y2 2X2Y
C、3X2+Y2
2X2Y
C、3X2+Y2
 2X3Y D、X2+3Y2
2X3Y D、X2+3Y2  2XY3
2XY3
解析:根据化学反应方程式的系数与分别用各物质表达的化学反应速率成正比的关系,只需分别计算同一时间内用各物质表达的化学反应速率,然后进行比较。答案:C
2、化学反应速率计算题型示例
(1)利用所给条件,利用表达式V= =△C/△t直接计算反应速率
例1、在一定条件下,反应N2+3H2  2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为
A、V(H2)=0.03mol/(L·min) B、V(N2)=0.02mol/(L·min) C、V(NH3)=0.17g/(L·min) D、V(NH3)=0.01mol/(L·min)
解析:根据题目可知VNH3=0.01mol/(L·min),根据反应系数与化学反应速率的关系可求出VH2=0.015mol/(L·min) .答案:D。
(2)根据“同一反应中各物质的反应速率之比等于化学方程式中各物质的系数之比”比较反应快慢大小。
例2、 可逆反应2A(g)+3B(g)  2c(g)+D(g)在四种不同条件下的反应速率分别为:
2c(g)+D(g)在四种不同条件下的反应速率分别为:
①υ(A)=0.5mol/(L·min) ②υ(B)=0.6mol/(L·min)
③υ(C)=0.35mol/(L·min) ④υ(D)=0.4mol/(L·min)
则该反应在不同条件下反应速率最快的是
A.① B.② C.③ D.④
解析: 在同一反应中,化学反应速率用不同物质的浓度变化表示,无法判断其反应速率
的慢快,需要根据反应速率之比等于物质的化学计量数之比换算成用同一物质表示的反应速率的数值才能比较其快慢程度.现将上述反应速率都用A的变化表示:
①v(A)=0.5mol(L·min)②v(A)=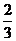 v(B)=0.4mol/(L·min)
v(B)=0.4mol/(L·min)
③v(A)=v(C)=0.35mol/(L·min)④v(A)=2v(D)=0.8mol/(L·min);
1、定义 。
数学表达式 。
单位 。
化学反应速率的表达式V= =△C/△t 单位mol/L·s或min(或其它时间单位)需要注意的是: (1)化学反应速率通常是指平均速率,即在一段时间内的平均速率;
(2)同一反应中,用不同物质表示的反应速率数值可以不同,因此,在表示反应速率时必须表明是何物质;
(3)同一反应中,各物质的反应速率之比等于化学方程式中各物质的系数之比;
(4)计算时,不管是反应物还是生成物,其浓度变化值均取绝对值,即化学反应速率总是正值。
11、人们常利用化学反应中的能量变化为人类服务。
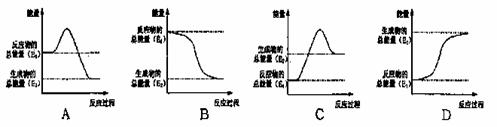
(1)煤是一种重要的燃料,在点燃条件下燃烧,放出大量的热。其在燃烧过程中能量的变化与如图所示中的 (填字母代号)最相符。
(2)将一定量的碳酸钠晶体与硝酸铵晶体密封于一塑料袋中,用线绳绑住塑料袋中间部分,使两种晶体隔开,做成“冰袋”。使用时将线绳解下,用手使袋内两种固体粉末充分混合,便立即产生低温,这种“冰袋”可用于短时间保鲜食物。则碳酸钠与硝酸铵的总能量 (填“高于”或“低于”)反应后生成产物的总能量。
(3)化学反应中的能量变化不仅仅表现为热能的变化,有时还可以表现为其它形式的能量变化。比如,停电时,人们一般点蜡烛来照明,这主要是将化学能转化为 ;人们普遍使用的干电池,是将化学能转化为 。
10、0.3mol气态高能燃料乙硼烷(分子式B2H6),在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ的热量,则其热化学方程式为______ .又已知H2O(l)===H2O(g);△H = +44kJ•mol-1,则11.2L标准状况下的乙硼烷完全燃烧生成气态水时放出的热量是__________kJ
9、(1)某化学反应,设反应物总能量为E1,生成物总能量为E2。若E1>E2,则该反应为________热反应,该反应过程可看成___ _____(2)中和反应都是______热反应,其实质是____________ ___________。
8、已知下列热化学方程式:
(1)Fe2O3(s)+3CO(g)====2Fe(s)+3CO2(g);ΔH=-25 kJ·mol-1
(2)3Fe2O3(s)+CO(g)====2Fe3O4(s)+CO2(g);ΔH=-47 kJ·mol-1
(3)Fe3O4(s)+CO(g)====3FeO(s)+CO2(g);ΔH=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式 .
7、已知在发射卫星时可用肼(N2H4)为燃料和NO2作氧化剂,这两者反应生成N2和水蒸气.又已知:
①N2(气)+2O2(气)==2NO2(气); △H=+67.7kJ/mol①
②N2H4(气)+O2(气)=N2(气)+2H2O(气); △H =-534kJ/mol②
试写出肼与NO2反应的热化学方程式_______________________________
6、在同温同压下,下列三个反应放出的热量分别以a,b,c表示,则a,b,c的关系是
①2H2(g)+O2(g)====2H2O(g);ΔH=-a ②2H2(g)+O2(g)====2H2O(l);ΔH=-b
③H2(g)+12O2(g)====H2O(g);ΔH=-c ( )
A.a>b,b=2c B.a=b=c C.a<b,c=1/2a D.无法比较
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com