
2.原电池的形成条件
(1)活泼性不同的电极材料(金属与金属或金属与非金属导体)
(2)电解质溶液
(3)构成闭合电路(用导线连接或直接接触)
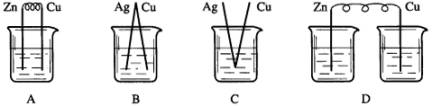
[练习]下列烧杯中盛放的都是稀H2SO4,在Cu电极上产生大量气泡的是(AA )
2、在如图所示的装置中,a的金属性比氢要强,b为碳棒,关于此装置的各种叙述不正确的是( BB )
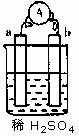
A.碳棒上有气体放出,溶液pH变大 B.a是正极,b是负极
C.导线中有电子流动,电子流从a极到b极 D.a极上发生了氧化反应
1、 原电池是__________________________________________________的装置。
原电池根据两极活泼性的不同,分为_______和________。正极和负极
正极:通常是活泼性较弱的金属或非金属导体,电子流____(填“出”或“入”)的一极,电极上发生________(填“氧化”或“还原”反应)。
负极:通常是活泼性较强的金属,电子流_____(填“出”或“入”)的一极,电极被________(填“氧化”或“还原”),电极发生________(填“氧化”或“还原”反应)。
如铜-锌原电池:锌片(-):Zn-2e-=Zn2+ 氧化反应;铜片(+):Cu2++2e-=Cu 还原反应
总反应式:Cu2++Zn=Cu+Zn2+
盐桥:盐桥存在,允许溶液中__迁移,以中和___,起了___的作用,使__的反应能继续进行。
[练习]1、下列关于原电池的叙述中正确的是( A A )
A.原电池能将化学能转变为电能
B.原电池负极发生的电极反应是还原反应
C.原电池在工作时其正极不断产生电子并经外电路流向负极
D.原电池的电极只能由两种不同的金属构成
复习目标:
1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.能根据氧化还原反应设计原电池。
3.了解常见化学电源的种类及其工作原理。
4.认识化学能与电能相互转化的实际意义及其重要应用。
复习重点:化学电源的种类及原电池的工作原理。
复习难点:根据氧化还原反应设计原电池。
课时划分:一课时
教学过程:
知识梳理
13.在一个容积为3L的密闭容器内进行如下反应:N2(气)+3H2(气) 2NH3(气)。反应开始时,n(N2)=1.5mol,n(H2)= 4.4mol,2min后,n(H2)=0.8mol。试用H2、N2和NH3的浓度变化来表示该反应的反应速率,并求出2min末的N2的浓度。
2NH3(气)。反应开始时,n(N2)=1.5mol,n(H2)= 4.4mol,2min后,n(H2)=0.8mol。试用H2、N2和NH3的浓度变化来表示该反应的反应速率,并求出2min末的N2的浓度。
12.(01·上海·24)某化学反应2A B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时问(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol·L-1)随反应时问(min)的变化情况如下表:
|
实验 序号 |
|
0 |
10 |
20 |
30 |
40 |
50 |
60 |
|
1 |
800℃ |
l.O |
O.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
|
2 |
800℃ |
C2 |
0.60 |
0.50 |
0.50 |
0.50 |
0.50 |
0.50 |
|
3 |
800℃ |
C3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
|
4 |
820℃ |
l.0 |
0.40 |
0.25 |
0.20 |
0.20 |
0.20 |
0.20 |
根据上述数据,完成下列填空:
(1)在实验l,反应在lO至20ain时间内平均速率为 mol/(L·min)。
(2)在实验2,A的初始浓度c2=mol·L-1,反应经20min就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1 (填“>”“=”“<”),且c3 1.0mol·L一1(填“>”‘=”‘<”)。
(4)比较实验4和实验1,可推测该反应是 反应(选填“吸热”“放
热”)。理由是 。
11.取2g干燥铝粉和3g碘粉小心混匀,分为四堆。往各堆上分别加0.5g水,1g明矾,1g胆矾,1g无水硫酸铜。加水那堆混合物首先冒火花,发生剧烈反应,其次发生反应的是加明矾的那一堆混合物,再次发生反应的是加胆矾的那一堆混合物,而加无水硫酸铜的那堆最难发生反应。
(1)铝和碘反应的方程式为___________。铝和碘反应还可以看到___________。
(2)四堆混合物发生反应的先后顺序说明_________________。
10. (01·全国理综·15)将4molA气体和2molB气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 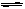 2C(g)若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
2C(g)若经2s后测得C的浓度为0.6mol·L-1,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为O.7mol·L-1
其中正确的是 ( )
A.①③ B.①④ C.②③ D.③④
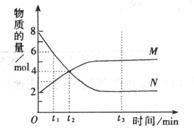
9.(01·全国理综·14)一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如下图,下列表述中正确的是 ( )
A.反应的化学方程式为:2M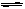 N B.t2时,正逆反应速率相等,达到平衡
N B.t2时,正逆反应速率相等,达到平衡
C.t3时,正反应速率大于逆反应速率 D.t1时,N的浓度是M浓度的2倍
8.在一个容积为2L的密闭容器中,发生如下反应:
3X(气)+Y(气)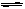 2Z(气)
2Z(气)
若最初加入的X、Y和Z都是1mol,反应中X的平均反应速率为0.12 mol·L-1·s-1。若要产物Z为1.8mol,反应所需的时间为( )
A、5s B、10s C、15s D、20s
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com