
20.利用反应Zn+2FeCl3===ZnCl2+2FeCl2组成一个化学电池
(1)在右边方格内画出实验装置图,并指出正极为______,电极反应式______,负极为_____,电极反应式___________。
(2)若电池内溶液为100mL0.5mol/LFeCl3溶液;当溶液中FeCl3全部被还原为FeCl2时,溶液中ZnCl2的物质的量浓度是多少?导线上通过的电子是多少摩?
19.由铜片、锌片和200mL稀硫酸组成的原电池中,若锌片发生电化腐蚀,则当铜片
上共放出3.36L(标准状况)气体时,硫酸恰好全部作用完。试计算:
(1)产生这些气体消耗了多少克锌?
(2)有多少个电子通过了导线?
(3) 200 mL稀硫酸的物质的量浓度是多少?
18、据报道,最近摩托罗拉(MOTOROLA)公司研发了一种由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次。假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
(1)该电池反应的总离子方程式为_________________________。
(2)甲醇在____极发生反应(填正或负),电池在放电过程中溶液的pH将____(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O2________升。
(3)最近,又有科学家制造出一种固体电解质的燃料电池,其效率更高。一个电极通入空气,另一电极通入汽油蒸气。其中固体电解质是掺杂了Y2O3(Y:钇)的ZrO2(Zr:锆)固体,它在高温下能传导O2-离子(其中氧化反应发生完全)。以丁烷(C4H10)代表汽油。
①电池的正极反应式为____________________________________________。
②放电时固体电解质里的O2-离子的移动方向是向____________极移动(填正或负)。
17、锌-锰干电池是普遍使用的化学电池,其中含有MnO2、NH4Cl、ZnCl2等糊状物。以锌筒为负极材料,石墨为正极材料。工作时反应方程式是:
Zn+2MnO2+2NH4+=Zn2++Mn2O3+2NH3+H2O
(1)试写出干电池放电时的正、负电极反应式:正极:__________________负极:____________干电池用久了就会变软,其原_____________________。
(2)正极反应中,前后经历下列反应:2NH4++2e-=2NH3+H2;2MnO2+H2=Mn2O3+H2O,如果没有MnO2参与,干电池将难于持续稳定工作。
试说明理由:_________________________________________________________________。
16.已知可逆反应:
AsO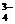 +2I-+2H+
+2I-+2H+ AsO
AsO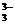 +I2+H2O
+I2+H2O
据此设计出如图所示的实验装置(装置中盐桥的作用是使整个装置形成一个闭合回路).进行如下操作:
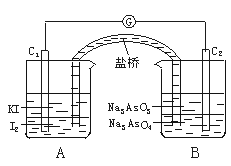
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安表指针偏转;
(Ⅱ)若改向(B)烧杯中滴加40% NaOH溶液,发现微安表指针向前述相反方向偏转.
试回答下列问题:
(1)两次操作过程中微安表指针为什么会发生偏转?
(2)两次操作过程中指针偏转方向为什么相反?
(3)(Ⅰ)操作过程中,C1棒发生的反应为_______________.
(4)(Ⅱ)操作过程中,C2棒发生的反应为_______________.
15.如图所示,烧杯内盛有浓HNO3,在烧杯中放入用铜线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余.试写出可能的电极反应式,并指出正、负电极及电极反应类型.
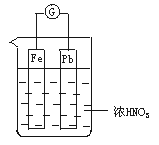
(1)Fe:____________ _、
______________ _(可不填满,也可补充,下同);
(2)pb片:____________________ _、
____________________ _.
14、我国首创的以铝-空气-海水电池为能源的新型海水标志灯已研制成功.这种灯以取之不尽的海水为电解质溶液,靠空气中的氧使铝不断氧化而源源产生电流.只要把灯放入海水中,数分钟后就会发出耀眼的闪光,其能量比干电池高20-50倍.试推测此种新型电池可能的基本结构及电极反应式:
(1)__________是负极,电极反应式为___________________________.
(2)__________是正极,电极反应式为___________________________.
13、下列叙述中,可以说明金属甲的活动性比金属乙的活动性强的是 ( )
A、在氧化-还原反应中,甲原子失去的电子比乙原子失去的电子多 B、同价态的阳离子,甲比乙的氧化性强
C、甲能跟稀盐酸反应放出氢气而乙不能
D、将甲、乙作电极组成原电池时,甲是负极
12.如图所示的装置,在盛有水的烧杯中,铁圈和银圈的相接处吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.

片刻后可观察到的现象是(指悬吊的金属圈)_______.
A.铁圈和银圈左右摇摆不定 B.保持平衡状态不变
C.铁圈向下倾斜 D.银圈向下倾斜
11、氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是
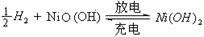
根据此反应式判断,下列叙述中正确的是
A、电池放电时,电池负极周围溶液的pH不断增大 B、电池放电时,镍元素被氧化
C、电池充电时,氢元素被还原 D、电池放电时,H2是负极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com