
1、我国古代湿法炼铜的反应原理是( )
A、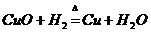 B、
B、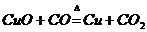
C、 D、
D、
4、A
[例3](2004年全国高考)粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20g A全部溶于0.15 L 6.0mol·L-1盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出1.12L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色;
请填空:
(1)①中引发铝热反应的实验操作是 。产物中的单质B是 。
(2)②中所发生反应的反应的化学方程式是 。
(3)③中所发生的各反应的离子方程式是 。
(4)若溶液D的体积仍视为0.15 L,则该溶液中c(Mg2+)为 ,c(Fe2+)为 。
解析:MgO不能与铝发生置换反应,所以①发生的反应是Fe2O3+2Al
 2Fe+Al2O3
2Fe+Al2O3
②中发生的反应是Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O
③中发生的反应是Fe+2FeCl3=3FeCl2,Fe+2HCl=FeCl2+H2↑
④中加入KSCN溶液不变色,说明Fe3+完全被还原为Fe2+,溶液D为MgCl2、FeCl2的混合液。根据题
意假设20g A中MgO和Fe2O3的物质的量均为x,则:40g·mol-1 x+160 g·mol-1 x=20g,解得x=0.1mol。
溶液中Mg2+的物质的量等于MgO的物质的量,c(Mg2≠)= =0.67 mol·L-1
=0.67 mol·L-1
反应后原加入的盐酸中的Cl-全部转移到FeCl2和MgCl2中,Cl-守恒,所以溶液D中
n(Cl-)=n(Mg2+)×2+n(Fe2+)×2= 6.0mol·L-1×0.15 L=0.9mol
n(Fe2+)= =0.35mol
=0.35mol
所以c(Fe2+)= =2.3 mol·L-1
=2.3 mol·L-1
答案:(1)加少量KClO3,插上镁条并将其点燃;Fe(2)Fe2O3+6HCl=2FeCl3+3H2O,MgO+2HCl=MgCl2+H2O(3)Fe+2H+=Fe2++H2↑;Fe+2Fe3+=3Fe2+(4)0.67 mol·L-1;2.3 mol·L-1
[例3]某化学课外小组用海带为原料制取了少量的碘水。现有CCl4从碘水中萃取碘并用分液漏斗分离出两种溶液。其实验操作可分解为如下几步: (A)把盛有溶液的分液漏斗放在铁架台的铁圈中;(B)把50mL碘水和15mLCCl4加入分液漏斗中,并盖好玻璃塞;(C)检验分液漏斗活塞上的玻璃塞是否漏液;(D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;(E)旋开活塞,用烧杯接收溶液;(F)从分液漏斗的上口倒出上层水溶液;(G)将漏斗上口的玻璃塞打开,使凹槽对准小孔;(H)静置,分层。
(1)正确的操作顺序是: _____→_____→_____→(A)→(G)→_____→(E)→(F)。(用编号字母填写)。
(2)上述(E)步骤的操作应注意:________________________________________。 上述(G)步骤操作的目的是_____________________________________________。
(3)能用CCl4萃取碘的原因是__________________________________________。 (4)下列物质,不能用作从溴水中萃取溴的溶剂是____________。 (A)苯(B)四氯化碳 (C)酒精(D)碘化钾
解答:⑴(C)(B)(D)(A)(G)(H)(E)(F) ⑵使漏斗下端管口紧靠烧杯内壁,及时关闭活塞,不让上层液体流出使漏斗内外空气相通,以保证进行E操作时漏斗里液体能顺利流出⑶CCl4与水互不相溶,而且碘在CCl4中的溶解度比在水中的大得多⑷苯及四氯化碳都是典型的有机溶剂,都能溶解溴,且都不溶于水,因而都可做溴的萃取剂,而酒精、碘化钾都溶于水,不能与水分层,所以不能做溴水的萃取剂,选(C)、(D)。
知能训练
3、HCl
抑制水解平衡MgCl2+H2O  Mg(OH)Cl+HCl正向进行
Mg(OH)Cl+HCl正向进行
2、2Cl--2e→Cl2 变大 4480 措施是向电解液中通入一定量的HCl气体
电解饱和食盐水时,与正极相连的阳极发生的反应是2Cl--2e-→Cl2,与负极相连的阴极发生的反应是:2H++2e-→H2。H+不断消耗,使得溶液中[OH-]增大,pH变大。电解中外溢的是Cl2、H2,所以要确保原溶液浓度不变,只能向体系中通入一定量的HCl气体以补足损失的H、Cl原子。易错处是加入盐酸,使溶液浓度变小。
1、B C D A或C B D A
该小题属离子除杂题。除杂原则是在除去Ca2+、Mg2+、SO42-时,不能带入杂质离子。所以,解此题的关键是把握好加入离子的顺序:①Ba2+必须在CO32-之前加入;②CO32-、OH-必须在H+之前加入,所以B、C不分先后,而D、A本身既分前后,又必须放在B、C之后才能满足条件。
4、电解无水MgCl2所得的镁蒸气可以在下列 气体中冷却。
A H2 B N2 C CO2 D O2
解析:
3、由MgCl2·6H2O晶体脱水制无水MgCl2时,MgCl2·6H2O晶体在 气氛中加热脱水,该气体的作用是 。
2、电解饱和食盐水时,与电源正极相连的电极上发生的反应为 。 与电源负极线连的电极附近溶液pH (变大、不变、变小)。若1mol电子的电量为96500C,则用电流强度为100A的稳恒电流持续电解3分13秒,则在两极上共可收集到气体 mL(S.T.P)。若保证电解后饱和食盐水的浓度不变,则可采取的方法是 。
1、粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:A 盐酸;B BaCl2溶液;C NaOH溶液;D Na2CO3溶液。加入试剂的顺序是 。
2、实验室制溴一般用NaBr、浓H2SO4、MnO2共热,即:
2NaBr
+ 2H2SO4(浓) + MnO2  Na2SO4 + MnSO4
+ Br2 + 2H2O
Na2SO4 + MnSO4
+ Br2 + 2H2O
典例剖析
[例1]冶炼金属一般有下列四种方法:①焦炭法;②水煤气(或氢气,或一氧化碳)法;③活泼金属置换法;④电解法。四种方法在工业上均有应用。古代有(Ⅰ)火烧孔雀石炼铜;(Ⅱ)湿法炼铜;现代有(Ⅲ)铝热法炼铬;(Ⅳ)从光卤石中炼镁,对它们的冶炼方法的分析不正确的是
A、(Ⅰ)用① B、(Ⅱ)用② C、(Ⅲ)用③ D、(Ⅳ)用④
解析:对于(Ⅰ)、(Ⅱ)、(Ⅲ)、(Ⅳ)发生的反应分别是
(Ⅰ)




 ,符合①
,符合①
(Ⅱ) ,适合于③
,适合于③
(Ⅲ)

 ,适合于③
,适合于③
(Ⅳ)先从光卤石中提取MgCl2 ,再电解MgCl2 ,MgCl2  Mg+Cl2↑,符合④。
Mg+Cl2↑,符合④。
综上分析,本题答案为B。
[例2]海水是取之不尽的化工原料资源,从海水中可提取各种化工原料。下图是工业上对海水的几项综合利用的示意图:

试回答下列问题:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com