
5.根据热化学方程式: S(s)+O2(g)=SO2(g);△H=-297.23kJ·mol-1 ,分析下列说法中正确的是
A. S(g)+O2(g)=SO2(g);|△H|>297.23kJ·mol-1
B. S(g)+O2(g)=SO2(g);|△H|<297.23kJ·mol-1
C. 1molSO2(g)所具有的能量大于1molS(s)与1molO2(g)所具有的能量之和
D. 1molSO2(g)所具有的能量小于于1molS(s)与1molO2(g)所具有的能量之和
4.已知25℃、101kPa下,石墨、金刚石燃烧的热化学方程式分别为
C(石墨) + O2(g) = CO2(g) ΔH = -393.51kJ·mol-1
C(金刚石) + O2(g) === CO2(g) ΔH = -395.41kJ ·mo-1
据此判断,下列说法中正确的是
A.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的低
B.由石墨制备金刚石是吸热反应;石墨的能量比金刚石的高
C.由石墨制备金刚石是放热反应;石墨的能量比金刚石的低
D.由石墨制备金刚石是放热反应;石墨的能量比金刚石的高
3.已知H2(g)+Cl2(g)=2HCl(g);△H=
-184.6kJ·mol-1,则反应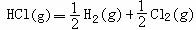 的△H为
的△H为
A.+184.6kJ·mol-1B.-92.3kJ·mol-1 C.-369.2kJ·mol-1 D.+92.3kJ·mol-1
2.化学反应过程中发生物质变化时,常常伴有能量的变化。这种能量的变化常以热能的形式表现出来,叫反应热。由于反应的情况不同,反应热可以分为多种,如燃烧热和中和热等等。下列△H表示燃烧热的是
A.2H2(g)+O2(g)===2H2O(l); △H1 B.C(s)+1/2O2(g)===CO(g);△H2
C.4NH3(g)+5O2(g)===4NO(g)+6H2O(l); △H3 D.C(s)+O2(g)===CO2(g); △H4
1.燃烧lg乙炔(C2H2)生成二氧化碳和液态水,放出热量50kJ,则这一反应的热化学反应方程式为
A.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H= +50 kJ·mol-1
B.C2H2(g)+5/202(g) 2CO2(g)+H2O(l);△H= -1300kJ
C.2C2H2+5O2 4CO2+2H2O;△H= -2600kJ
D.2C2H2(g)+5O2(g) 4CO2(g)+2H2O(l);△H= -2600 kJ·mol-1
△H=-25 KJ/mol-(-9 KJ/mol)
整理得: ;△H=-16
KJ/mol
;△H=-16
KJ/mol
例4、硝化甘油(C3H5N3O9)分解时产物为N2、CO2、O2和H2O,它的分解反应方程式是:_____________________;已知20℃时,2.27g硝化甘油分解放出热量15.4kJ,则每生成1 mol气体伴随放出的热量为________kJ。
解析:本题已给出了硝化甘油的分子式和分解产物,反应方程式配平得:4C3H5N3O9=6N2+12CO2+O2+10H2O
2.27g硝化甘油的物质的量为: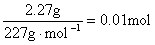
硝化甘油分解反应的反应热:△H=-1540 KJ/mol
4 mol硝化甘油分解产生20℃时的气体19 mol(在给定条件下,水是液态)。每生成1mol气体(在给定条件下,水是液态)伴随放出的热量为:
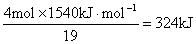
例5、(2004年全国高考理综试题• 云南等八省区卷)已知
⑴ H2(g)+
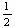 O2(g)==H2O(g);△H1=aKJ•mol-1
O2(g)==H2O(g);△H1=aKJ•mol-1
⑵ 2H2(g)+O2(g)==2H2O(g);△H2=bKJ•mol-1
⑶ H2(g)+
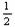 O2(g)==H2O(l); △H3=cKJ•mol-1
O2(g)==H2O(l); △H3=cKJ•mol-1
⑷ 2H2(g)+O2(g)==2H2O(l);△H4=dKJ•mol-1
下列关系式中正确的是( )
A.a<c <0 B.b>d>0 C.2a=b<0 D.2c=d>0
解析:⑴、⑵式反应物、生成物的状态均相同,⑴×2=⑵,即2△H1=△H2,2a=b,又H2的燃烧反应为放热反应,故2a=b<0,C项符合题意。同理,⑶×2=⑷,有2c=d<0,D项错误。对于A项,据盖斯定律可设计如下反应过程:
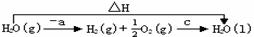 ,
,
由于气态水转变为液态水要放热,有△H=-a+c<0,c<a<0,A项错误。对于B项,可设计如下反应过程:
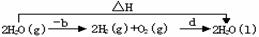 ,
,
同理,△H=-b+d<0,d<b<0,B项错误。
知能训练
例1、化工生产中用烷烃和水蒸气反应得到以CO和H2为主的混合气体。这种混合气体可用于生产甲醇或合成氨,对甲烷而言,有以下两个主要反应:
①CH4(g)+ O2(g)=CO(g)+2H2(g);△H1=-36kJ/mol
O2(g)=CO(g)+2H2(g);△H1=-36kJ/mol
②CH4(g)+H2O(g)=CO(g)+3H2(g);△H2=+216kJ/mol
由反应①、②推出总反应热为零的总反应方程式③,并求进料气中空气(O2的体积分数为21%)与水蒸气的体积比。
解析:根据盖斯定律:m1·△H1+m2·△H2=△H3=0,所以
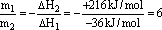
总反应热为零的反应方程式为6×①+②
③7CH4(g)+3O2(g)+H2O(g)=7CO(g)+15H2(g);△H=0
从方程式知:进料气中V(O2):V[H2O(g)]=3:1,
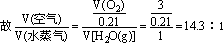
变式练习1、(2005广东22·4) 由金红石(TiO2)制取单质Ti,涉及到的步骤为::
TiO2 TiCl4
TiCl4 Ti
Ti
已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
答案:-80 kJ·mol-1
例2、实验中不能直接测出由石墨和氢气生成甲烷反应的ΔH,但可测出CH4燃烧反应的ΔH,根据盖斯定律求ΔH4
CH4(g)+2O2(g)=CO2(g)+2H2O(l);ΔH1=-890.3kJ·mol-1 (1)
C(石墨)+O2(g)=CO2(g);ΔH2=-393·5kJ·mol-1 (2)
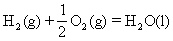 ;ΔH3=-285.8kJ·mol-1 (3)
;ΔH3=-285.8kJ·mol-1 (3)
C(石墨)+2H2(g)=CH4(g);ΔH4 (4)
解析:利用盖斯定律时,可以通过已知反应经过简单的代数运算得到所求反应,以此来算得所求反应的热效应。也可以设计一个途径,使反应物经过一些中间步骤最后回复到产物:
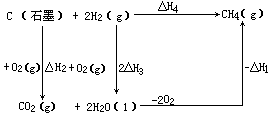
因为反应式(1),(2),(3)和(4)之间有以下关系:
(2)+(3)×2-(1)=(4)
所以 ΔH4=ΔH2+2ΔH3-ΔH1=-393.5 kJ·mol-1+2(-285.8) kJ·mol-1-(-890.3) kJ·mol-1
=-74.8kJ·mol-1
例3、已知下列热化学方程式:
(1)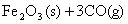
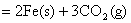 ;△H=-25 KJ/mol
;△H=-25 KJ/mol
(2)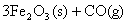
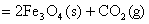 ;△H=-47 KJ/mol
;△H=-47 KJ/mol
(3)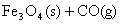
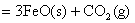 ;△H=+19 KJ/mol
;△H=+19 KJ/mol
写出FeO(S) 被CO还原成Fe和CO2的热化学方程式______________。
解析:依据盖斯定律:化学反应不管是一步完成还是分几步完成,其反应热量是相同的。我们可从题目中所给的有关方程式分析:从方程式(3)与方程式(1)可看出有我们需要的有关物质。但方程式(3)必须通过方程式(2)有关物质才能和方程式(1)结合在一起。将方程式(3)×2+方程式(2);可表示为(3)×2+(2):
得: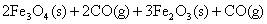
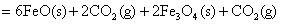 ;
;
△H=+19 KJ/mol×2+(-47 KJ/mol)
整理得(4):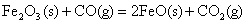 ;△H=-9
KJ/mol
;△H=-9
KJ/mol
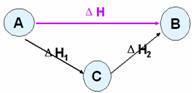
思考:ΔH、ΔH1、ΔH2之间有何关系?(ΔH=ΔH1+ΔH2)。
例如:
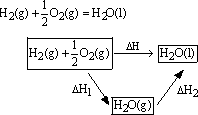
可以通过两种途径来完成。如上图表:已知:
H2(g)+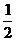 O2(g)= H2O(g);△H1=-241.8kJ/mol
O2(g)= H2O(g);△H1=-241.8kJ/mol
H2O(g)=H2O(l);△H2=-44.0kJ/mol
根据盖斯定律,则
△H=△H1+△H2=-241.8kJ/mol+(-44.0kJ/mol)=-285.8kJ/mol
其数值与用量热计测得的数据相同。
不管化学反应是分一步完成或分几步完成,其反应热是相同的。换句话说,化学反应的反应热只与反应体系的__态和__态有关,而与反应的__无关。这就是盖斯定律。
23..欲测定烟雾中的SO2含量,可做下列实验:取100L该空气(标准状况),通过盛放100mL过氧化氢(H2O2)水溶液的吸收瓶,使它们充分反应,生成硫酸。在吸收后的水溶液中加入BaCl2溶液,生成白色沉淀,经测定其质量为11.65g。
(1)试写出SO2和H2O2反应的离子方程式。
(2)写出H2SO4与BaCl2反应的离子方程式。
(3)求100L空气中SO2的体积分数。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com