
3、温度对化学平衡的影响
任何反应都伴随着能量的变化,通常表现为放热或吸热;所以温度对化学平衡移动也有影响。
如果升高温度,平衡向_____的方向移动;降低温度平衡向_____的方向移动。
练习:可逆反应2A+B 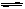 2C,在不同压强及温度下达成平衡时,c的百分含量情况如图所示。
2C,在不同压强及温度下达成平衡时,c的百分含量情况如图所示。
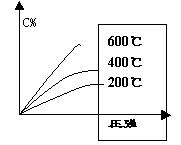
回答
(1)该反应的正反应是___热反应,逆反应是气体体积___的反应。
(2)若c是气态,则A为___态,B为___态。
(3)若B为固态,则A为___态,c为___态。
答案:(1)吸,扩大,(2)气,气(3)气,固态或液态
浓度、压强、温度对化学平衡的影响可以概括为平衡移动的原理,也叫勒夏特列原理:_______________________________________________。
催化剂能够同等程度的改变正逆反应的速率,所以使用催化剂不能使平衡发生移动,但是可以改变达到平衡所需要的时间。
疑难点拨
疑难点拨
化学平衡是有条件的动态平衡,当影响化学平衡的条件改变时,原来的平衡被破坏,进而在新的条件下逐渐建立新的平衡,这个原平衡向新平衡的转化过程叫做化学平衡的移动
1.浓度对化学平衡的影响
增大反应物浓度,或减小生成物浓度。化学平衡向______移动。减小反应物浓度,或增大生成物浓度。化学平衡向______移动。注意:固体物质和纯液体无所谓浓度,其量改变,不影响平衡。
4、转化率
若定义某反应物M在可逆反应中的转化率为:
M的转化率= 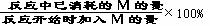
那么如果M的转化率不再随时间而改变,也证明可逆反应已达到平衡状态。
[练习]1.x、y、z都是气体,反应前x、y的物质的量之比是1:2,在一定条件下可逆反应x+2y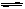 2z达到平衡时,测得反应物总的物质的量等于生成物总的物质的量,则平衡时x的转化率(D)
2z达到平衡时,测得反应物总的物质的量等于生成物总的物质的量,则平衡时x的转化率(D)
A.80% B.20% C.40% D.60%
2:已知在450℃时,反应H2(g)+I2(g) 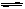 2HI(g)的K为50,由此推断出在450℃时,反应2HI(g)
2HI(g)的K为50,由此推断出在450℃时,反应2HI(g)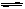 H2(g)+I2(g)的化学平衡常数为 (B)
H2(g)+I2(g)的化学平衡常数为 (B)
A、50 B、0.02 C100 D无法确定
2、对于一般的可逆反应mA+nB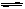 pC+qD,在一定温度下达平衡时反应物及生成物浓度满足下面关系:
pC+qD,在一定温度下达平衡时反应物及生成物浓度满足下面关系: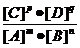 =K,式中K为常数,在密闭容器中给CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H20
=K,式中K为常数,在密闭容器中给CO和水蒸气的混合物加热到800℃时,有下列平衡:CO+H20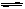 C02+H2且K=1,若用2molCO和10molH20(气)相互混合并加热到800℃,达平衡时CO的转化率约为(D)
C02+H2且K=1,若用2molCO和10molH20(气)相互混合并加热到800℃,达平衡时CO的转化率约为(D)
A.16.7% B.50% C.66.7% D.83%
3、化学平衡常数:
(1)化学平衡常数的表示方法
对于一般的可逆反应:mA+ n B 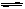 p C + q D。其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数可以表示为:
p C + q D。其中m、n、p、q分别表示化学方程式中个反应物和生成物的化学计量数。当在一定温度下达到化学平衡时,这个反应的平衡常数可以表示为:
k=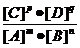
在一定温度下,可逆反应达到化学平衡时,生成物的浓度,反应物的浓度的关系依上述规律,其常数(用K表示)叫该反应的化学平衡常数
(2化学平衡常数的意义
平衡常数的大小不随反应物或生成物的改变而改变,只随温度的改变而改变。即,K=f (T)。平衡常数表示的意义:可以推断反应进行的程度。K很大,反应进行的程度很大,转化率大
K居中,典型的可逆反应,改变条件反应的方向变化。
K很小,反应进行的程度小,转化率小
[练习]1.对反应2N02(气) 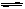 ?N204(气),在温度不变时
?N204(气),在温度不变时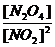 =K是个常数数;称为化学平衡常数,在弱电解质溶液中也是如此。欲使
=K是个常数数;称为化学平衡常数,在弱电解质溶液中也是如此。欲使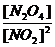 比值增大,在温度不变时应采取
(BD)
比值增大,在温度不变时应采取
(BD)
A.体积不变,增加N02物质的量 B.体积不变,增加N204物质的量
C.使体积缩小到原来的一半 D.使压强不变充入N2
2.化学平衡状态
(1)定义:
(2)特征:①逆:②等:③动:④定:⑤变:
(3)特点:化学平衡的建立与建立的途径无关
(4)达到平衡的标志:
 以mA(g)+nB(g) pC(g)为例
以mA(g)+nB(g) pC(g)为例
直接标志:
①速率关系:正反应速率与逆反应速率相等,A消耗速率与A的生成速率相等,A消耗速率与C的消耗速率之比等于m∶p,B生成速率与C的生成速率之比等于n∶p。
②各物质的百分含量保持不变。
间接标志:
①混合气体的总压强、总体积、总物质的量不随时间的改变而改变。
②各物质的浓度不随时间的改变而改变。
③各物质的物质的量不随时间的改变而改变。
④各气体的体积、各气体的分压不随时间的改变而改变。
化学平衡:在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓
度保持不变的状态,称为化学平衡状态,简称化学平衡。
1.化学平衡的建立
以CO+H2O(g)
 CO2+H2反应为例。
CO2+H2反应为例。
在一定条件下,将0.01 mol CO和0.01 mol H2O(g)通入1 L密闭容器中,开始反应:
(1)反应刚开始时:
反应物的浓度__________,正反应速率 。
生成物的浓度__________,逆反应速率__________。
(2)反应进行中:
反应物的浓度__________,正反应速率__________。
生成物的浓度__________,逆反应速率__________。
(3)肯定最终有一时刻,正反应速率与逆反应速率__________,此时,反应物的浓度__________,生成物的浓度也__________。
正反应速率和逆反应速率随时间的变化关系如图所示。
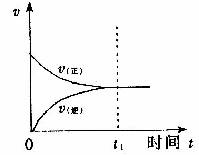
正反应:__________,逆反应:_____________。
可逆反应:______________________________。
可逆反应的特征:“两同”是指______________________。
可逆反应的重要特征是转化率永远不可能达到100%,也就是反应一旦开始,那么,就不可能只存
在反应物,或只存在生成物。
20.在合成氨时,将1体积氮气和3体积氢气混合后通过合成塔中的催化剂,若从塔中导出的混合气体中,氨气的体积分数为12%,求N2和H2的体积分数各为多少?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com