
1、概念:____________叫共价键。
写出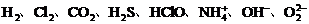 的电子式和结构式。
的电子式和结构式。
___、____、____、____、____、____、____、____。
3.用电子式表示出离子化合物的形成过程。
用电子式表示MgO、K2S形成过程:___________、___________。
注意:
(1)首先考虑箭号左方原子的摆放,并写出它们的电子式。
(2)箭号右方写离子化合物的电子式。写时要注意二标:标正负电荷、阴离子标[]。
(3)箭号左方相同的微粒可以合并写,箭号右方相同的微粒不可以合并写。
(4)在标正负电荷时,特别要注意正负电荷总数相等。
2.电子式:_______________的式子。
原子电子式:H___ Cl___ S___ Ar___ Mg___
离子电子式:Na+__ Mg2+__OH-___NH4+__。
1._______________所形成的化学键叫做离子键。
成键微粒:____;相互作用:________;成键过程:________。
举例哪些物质能提供阴、阳离子:_______________、_______________、_______________。
25. 如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)
如图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g) 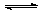 Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
⑴A中X的转化率为 。
⑵A、B中X转化率大小关系为A B(填“>”、
“<”、“=” =
⑶打开K,一段时间后又达到新的平衡时,
A的体积为 L(连通管中气体体积不计)
⑷在⑶达到平衡后,同时等幅升高A、B的温度,达到平衡后,A的体积 (填变大、不变、或变小),其理由是
24.(2005年南京二测,)某温度下,向某密闭容器中加入相对平均分子质量为8.5的N2和H2的混合气体4mol使之反应合成氨,达平衡后测得NH3的体积分数为m。保持温度不变,只改变起始物质的加入量使反应重新达到平衡后,NH3的体积分数仍为m。若N2、H2、NH3的加入量分别用x、y、z表示,则x、y、z应满足:
①温度、体积恒定时,若x=0,y=0,则z= ;温度、压强恒定时,若x=0,y=0,则z ;
②温度、体积恒定时,若x=0.75mol,则y= ,z= ;温度、压强恒定时,若x=0.75mol,则y= ,z ;
③温度、压强恒定时,x、y、z应满足的关系是: 。
23.(05年北京海淀)在实验室中做下列实验:把物质A、B按一定比例充入一个表面积为300 ,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
,容积为2 L的球形容器,使压强为P,然后将整个容器用加热器加热到t℃时,发生如下反应:
2A(g)+B(g) 2C(g);H=-180 kJ·
2C(g);H=-180 kJ·
(1)若平均每分钟生成0.5
mol的C,则此反应速率可表示为v(C)=____________;若容器表面向外散热速率平均为400 J· ·
· ,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
,为了维持恒温t℃,平均每分钟需用加热器提供________kJ的热量;
(2)反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是_____ ___。
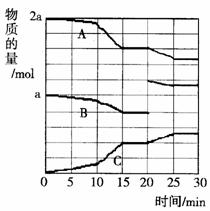
A.10-15 min可能是加入了正催化剂 B.10-15 min可能是降低了温度
C.20 min时可能是缩小了容器体积 D.20 min时可能是增加了B的量
22.(05年北京朝阳统考)在一定条件下发生反应2SO2(g)+O2(g)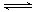 2SO3(g);
2SO3(g);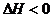
(1)500℃时,将a mol SO2与b mol O2以3:2通入固定容积为5L的密闭容器中。
①反应进行至10min时,测得n(SO2)=8mol,n(SO3)=4mol,则b=___________mol。
②反应进行至10min时,测得反应放热392kJ,则上述热化学方程式中的
ΔH=____________________________________________。
③10min内平均速率v(SO2)=___________________________________________。
④反应达到平衡后,测得容器内压强是反应起始压强的0.715倍,则平衡时
c(SO3)=___________________,SO2的转化率α1(SO2)=________________。
(2)当反应温度、起始SO2与O2物质的量均与(1)相同时,将其混合气通入一恒压反应容器中,达平衡时SO2的转化率 与(1)中转化率
与(1)中转化率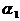 的关系是
的关系是 ___________
___________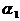 (填=、>或<=
(填=、>或<=
21.(CuCl2溶液有时呈黄色,有时呈黄绿色或蓝色,这是因为在CuCl2的水溶液中存在如下平衡:
[Cu(H2O)4]2++4C1一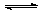 [CuCl4]2-
+4H2O
[CuCl4]2-
+4H2O
蓝色 黄色
现欲使溶液由黄色变成黄绿色或蓝色,请写出两种可采用的方法
⑴ ⑵ 。
20.在重铬酸钾(K2Cr2O7)溶液中存在如下平衡:
Cr2O72-
+H2O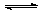 2HCrO4
2HCrO4
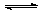 2 CrO42-+2H+
2 CrO42-+2H+
⑴加入H2SO4,使K2Cr2O7溶液的pH降低,则溶液中c(Cr2O72-)与c(CrO42- )的比值将 填“增大”“减少”或“不变”)
⑵向K2Cr2O7溶液中加入AgNO3溶液,发生离子互换反应,生成砖红色沉淀且溶液pH下降,生成的砖红色沉淀的化学式为 。
(3)重铬酸钾在酸性溶液中是强氧化剂。例如它在H2SO4存在的条件下要把Fe2+离子 氧化成Fe3+离子,本身被还原成Cr3+离子。该反应的离子方程式为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com