
9. 下列变化过程中,共价键被破坏的是
A. 烧碱固体溶于水 B. 氯化氢气体溶于水
C. 二氧化碳变成干冰 D. 碘溶于酒精
8.下列性质中,可以证明某化合物中一定存在离子键的是
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
7.下列事实中,能够证明HCl是共价化合物的是:
A.HCl易溶于水; B.液态的HCl不导电;
C.HCl不易分解; D.HCl溶于水能电离,呈酸性。
5、在下列有关晶体的叙述中错误的是
A.离子晶体中,一定存在离子键 B.原子晶体中,只存在共价键
C.金属晶体的熔、沸点的均很高 D.稀有气体的原子能形成分子晶体
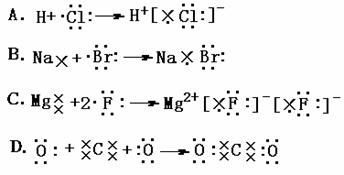 6.下列表示电子式的形成过程正确的是:
6.下列表示电子式的形成过程正确的是:
4、关于氢键,下列说法正确的是
A、氢键比范德华力强,所以它属于化学键
B、分子间形成的氢键使物质的熔点和沸点升高
C、由于NH3和H2O之间可形成分子间氢键,使氨在水中溶解度增大
D、H2O是一种稳定的化合物,这是由于H2O之间形成氢键所致
3、下列各项表达正确的是
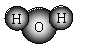 A.H2O的分子模型示意图:
B.F-的结构示意图:
A.H2O的分子模型示意图:
B.F-的结构示意图:
C.乙烯分子的结构简式:CH2CH2
D.CaCl2的电子式: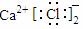
2、下列分子中所有原子最外层都满足8电子结构的是
A、次氯酸(HClO) B、CF2Cl2 C、三氟化硼(BF3) D、白磷(P4)
1、下列物质中属于含有极性共价键的离子化合物的是
A、过氧化钠 B、碘化氢 C、苛性钠 D、氯化钾
分子缔合作用,是由于分子间氢键的形成,钳环化则是由于分子内氢键的形成。两者对于化合物的性质的影响是显著的,并且往往是相反的,现简述如下。
(1)对沸点和熔点的影响:分子间氢键的形成使物质的沸点和熔点升高,因为要使液体气化,必须破坏大部分分子间的氢键,这需要较多的能量;要使晶体熔化,也要破坏一部分分子间的氢键。所以,形成分子间氢键的化合物的沸点和熔点都比没有氢键的同类化合物为高。
分子内氢键的生成使物质的沸点和熔点降低,如邻位硝基苯酚的熔点为45 ℃,而间位和对位硝基苯酚的熔点分别是96 ℃和114 ℃。这是由于间位和对位硝基苯酚中存在着分子间氢键,熔化时必须破坏其中的一部分氢键,所以它们熔点较高;但邻位硝基苯酚中已经构
成内氢键,不能再构成分子间氢键了,所以熔点较低。
(2)对溶解度的影响:在极性溶剂里,如果溶质分子与溶剂分子间可以生成氢键,则溶质的溶解度增大。如果溶质分子钳环化,则在极性溶剂里的溶解度减小。例如,对硝基苯酚中O-H基,能同水的氧原子缔合成氢键,促使它在水中溶解,因此溶解度大,在水蒸气里不挥发。但邻硝基苯酚的O-H基,通过氢原子能与其邻位上硝基的氧原子钳环化,即不能再同水的氢原子形成氢键,因此溶解度减小,而且易被水蒸气蒸馏出去。邻位与对位硝基苯酚在20 ℃的水里的溶解度之比为0.39。钳环化的化合物在非极性溶剂里,其溶解度与上述情况相反。
(3)对酸性的影响:如苯甲酸的电离常数为K,则在邻位、间位、对位上带有羟基时,电离常数依次为15.9 K、1.26K和0.44 K。如左右两边邻位上各取代一羟基,则电离常数为800 K。这是由于邻位上的羟基与苯甲酸根生成带氢键的稳定的阴离子,从而增加了羧基中氢原子的电离
典例剖析
[例1]下列说法中正确的是 A、离子键是阴阳离子间存在的静电引力 B、失电子难的原子获得电子的能力一定强 C、在化学反应中,某元素由化合态态变为游离态,该元素被还原。 D、电子层结构相同的不同离子,其半径随核电荷数增多而减少。 解析:A错。静电作用包括引力和斥力两方面的作用。B:失电子难的原子,获得电子的能力不一定强,例如稀有气体,失电子难,得电子也难。C:化学反应中,元素的化合态变为游离态,可能被氧化,也可能被还原。如: CuCl2+Fe→FeCl2+Cu, 则Cu2+被还原;CuBr2+Cl2→CuCl2+Br2 则Br-被氧化D是对的,答案为D。 [例2]下列叙述正确的是 A、两种非金属原子间不可能形成离子键。B、非金属原子间不可能形成离子化合物。 C、离子化合物中可能有共价键。 D、共价化合物中可能有离子键。 解析:两种非金属原子间不能得失电子,不能形成离子键,A对,非金属原子,当组成原子团时,可以形成离子的化合物,如NH4Cl, B错;离子化合物中可以有共价键,如:NaOH中的O-H键,C对;有离子键就是离子化合物,D错。答案为A、C。 [例3] 以下叙述中错误的是
A. 钠原子与氯气反应生成食盐后,其结构的稳定性增强
B. 在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子,原子核与原子核之间的排斥作用
C. 任何离子键在形成过程中必定有电子的得与失
D. 钠与氧气反应生成氧化钠后,体系的能量降低
解析:钠原子最外层只有一个电子,当它失去1个电子后可以形成8个电子的稳定结构使体系的能量降低,所以A、D项均正确;在离子化合物中除阴阳离子电荷之间的静电引力外,还存在电子与电子,原子核与原子核之间的排斥作用,所以B项正确;一般说来形成离子键有电子的得失,但也有例外如铵盐的形成。答案:C。
[例4]有A、B、C、D四种元素。已知:A的最高正价与其最低负价的代数和为6,A、D次外层电子都是8个,A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴,阳离子,B有两个电子层,其最高正价与最低负价的代数和为零;C2-离子与氪原子具有相同的电子层结构。试写出: (1)上述各元素的符号:A_____B_____C_____D_____。 (2)DA的电子式为________。 解析:最高正价与负价代数和为6的元素位于第ⅦA族(+7,-1)。最高正价与负价代数和为4的元素位于第ⅥA族(+6,-2)。第ⅤA族的最高正价与负价的代数和为2(+5,-3)。第ⅣA族元素的最高正价与负价的代数和为零(+4,-4)。所以A位于ⅦA,B位于ⅣA,B有两个电子层,B为碳元素。C2-离子与氪原子具有相同的电子层结构,所以C为ⅥA族并位于第四周期,即为Se元素。A和D的化合物DA在水溶液中能电离出具有相同电子层结构的阴、阳离子,且A、D次外层都有8个电子,所以A为氯元素,D为钾元素。答案:(1)Cl、C、Se、K。
知能训练
3、特征不同:离子键无饱和性和方向性;共价键有方向性和饱和性。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com