
9.(2000广东)用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是[ ]
A.加热 B.不用稀硫酸,改用98%浓硫酸
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉
8.(2001广东、河南)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充、放电反应应按下式进行:
Cd(OH)2+2Ni(OH)2 Cd+2NiO(OH)+2H2O
由此可知,该电池放电时的负极材料是[ ]
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
7.据报道,美国正在研究的锌电池可能取代目前广泛使用的铅酸蓄电池,锌电池具有容量大,污染少等优点,电池反应为2Zn+O2=2ZnO,原料为锌粒、电解液和空气.下列叙述正确的是[ ]
A.锌为正极,空气进入负极反应 B.负极反应为:Zn-Ze-=Zn2+
C.正极发生氧化反应 D.电解质溶液肯定不是酸溶液
6.下列叙述正确的是[ ]
A.原电池中阳离子向负极移动B.原电池的负极发生氧化反应
C.马口铁(镀锡)的表面一旦破损,铁腐蚀加快
D.白铁(镀锌)的表面一旦破损,铁腐蚀加快
5.(2001上海)铜片和锌片用导线连接后插入稀硫酸中,锌片是[ ]
A.阴极 B.正极 C.阳极 D.负极
4.下列叙述中不正确的是[ ]
A.金属的电化腐蚀比化学腐蚀普遍 B.钢铁在干燥空气里不易腐蚀
C.用铝质铆钉铆接铁板,铁板易被腐蚀 D.原电池中电子由正极流入负极
3.把a、b、c、d四块金属片浸泡在稀H2SO4溶液中,用导线两两相连,可以组成各种原电池,若a、b相连,a为负极;c、d相连时,c为负极;a,c相连时,c为正极;b、d相连时,b为正极,则这四种金属的活动性顺序(由强到弱的顺序)为[ ]
A.a>b>c>d B.a>c>d>b C.c>a>b>d D.b>d>c>a
2.钢铁发生吸氧腐蚀时,正极上发生的电极反应是[ ]
A.2H++2e-=H2 B.Fe2++2e-=Fe
C.2H2O+O2+4e-=4OH- D.Fe3++e-=Fe2+
1.分别放置在图所示装置(都盛有0.1 mol·L-1的H2SO4溶液)中的四个相同的纯锌片,腐蚀最快的是
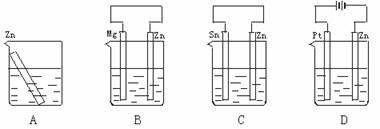
1、牺牲阳极保护法2、外加电流法
[总结]判断金属腐蚀快慢的规律:
(1)电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防护腐蚀措施的腐蚀; (2)同种金属的腐蚀在强电解质中>弱电解质中>非电解质中; (3)活泼性不同的两金属,活泼性差别越大,腐蚀越快; (4)对同一电解质溶液来说,电解质溶液浓度越大,腐蚀越快。 防止金属腐蚀主要有改变金属的成分、在金属表面覆盖保护层及电化学保护法等。
典例剖析
例1、 钢铁发生电化学腐蚀时,负极发生的反应是 A.2H++2e-=H2 B.2H2O+O2+4e-=4OH- C.Fe-2e-=Fe2+ D.4OH--4e-=2H2O+O2 解析:钢铁发生电化学腐蚀时,负极上发生的电极反应是:Fe-2e-=Fe2+;正极上发生的电极反应,吸氧腐蚀是:2H2O+O2+4e-=4OH-,析氢腐蚀是:2H++2e-=H2。答案 C
例2、在体积相同、浓度同为4.0mol/L的盐酸中,一份加入纯锌,另一份加入含有杂质铜的金属锌,哪个反应产生的氢气速率快?简述其原因。
解析:纯锌跟盐酸发生的是置换反应,含有铜的金属锌跟盐酸发生的电化学反应,无数Cu-Zn微小原电池的形成,使化学反应速率加快。含有杂质铜的金属锌跟盐酸反应速率快,这是由于Cu、Zn构成原电池的正极和负极,其电极反应式为:
(-)极 Zn-2e-= Zn2+(+)极 2H++2e-=H2↑。
在相同条件下,电化学反应比化学反应的反应速率快得多。
例3:埋在地下的钢铁管道容易腐蚀而损坏,其原因在哪里?应采取何种措施保护埋在地下的管道?
解答:地下钢铁管道容易腐蚀的原因是发生电化学腐蚀。可在管道外壁涂沥青保护层,使钢铁管道跟周围电解质溶液隔离开来,破坏原电池形成的条件,从而使地下钢铁管道得到保护。另外,可把比Fe更活泼的Zn联结在钢铁管道,Zn作为原电池的负极被腐蚀,而钢铁管道则被保护。
例4、如图各容器中盛有海水,铁在其中腐蚀时由快到慢的顺序是
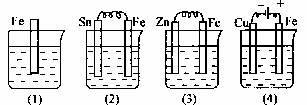
A.④>②>①>③ B.②>①>③>④ C.④>②>③>① D.③>②>④>① 解析: 金属腐蚀的快慢判断方法:电解原理引起的腐蚀>原电池原理引起的腐蚀>化学腐蚀>有防腐蚀措施的腐蚀;同一种金属腐蚀:强电解质>弱电解质>非电解质溶液。②、③实质均为原电池装置,④为电解池装置,Fe作阳极,腐蚀最快。③中Fe为正极,被保护;②中Fe为负极,被腐蚀,①中因铁不纯而发生微电池反应。答案:A。
例5:有4种金属。a、b、c、d,当它们两两组成原电池时,金属a都是正极;在这4种金属组成的混合物中,加入足量的盐酸,可使金属b和c溶解;过滤后,在滤液中加入过量NaOH溶液,得到c离子形成的沉淀。由此可知这4种金属的活动性由强到弱的正确顺序可能是下列中的
A、a c b d B、c b d a C、b c d a D、a b c d
解析:当两种金属组成原电池两极时,总是不活泼金属作正极,由此可知在 a、b、c、d 4种金属中,a是最不活泼的金属。又从在a、b、c、d混合物中加入盐酸,可使金属b、c溶解,说明b、c比d要活泼。根据以上分析,可以排除掉选项A和选项D。b、c两种金属谁更活泼,不能从c的离子与过量NaOH反应生成沉淀得到解答,因为这种c离子的沉淀若为Mg(OH)2,则c>b,若c离子沉淀为Fe(OH)3,则b>c(假定b为金属锌)。答案:B、C。
例6、 下表数据是在某高温下,金属镁和镍分别在氧气中进行氧化反应时,在金属表面生成氧化薄膜的实验记录:
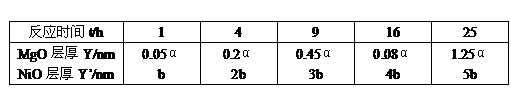
*α和b均为与温度有关的常数
请填空回答:
(1)金属高温氧化腐蚀速率可以用金属氧化膜的生长速率来表示,其理由是_______。
(2)金属氧化膜的膜厚跟时间t所呈现的关系是(填直线、抛物线、对数或双曲线等类型):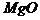 氧化膜厚Y属_________型;
氧化膜厚Y属_________型;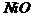 氧化膜的膜厚Y’属________型。
氧化膜的膜厚Y’属________型。
(3)Mg与Ni比较,哪一种金属具有良好的耐氧化腐蚀性:____________,其理由是_______________。
解题策略:本题应从实验数据出发,建立数学模型,进而从物质内部结构作出解释。这种题型是定量描述自然科学现象和规律的体现。金属因高温氧化反应,遭到破坏是常见的一种腐蚀性现象。化学反应的快慢,既可由反应物消耗速率,也可由产物的生成速率来表示,故金属腐蚀速率可以用其氧化膜的生长速率来表示。根据题中表列数据,不难导出以下关系式:
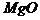 膜厚Y与时间t的关系为:
膜厚Y与时间t的关系为: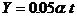
NiO膜厚Y’与时间t的关系为: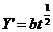
前者为直线型,而后者为抛物线型。这表明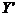 随时间t增长要比Y随时间t增长得慢,所以镍的耐高温腐蚀性要比镁的为好。
随时间t增长要比Y随时间t增长得慢,所以镍的耐高温腐蚀性要比镁的为好。
答案:(1)反应速率可以用反应物的消耗速率,也可以用产物的生成速率表示;
(2)直线,抛物线;
(3)Ni,它的腐蚀速率随时间的增长比镁的要慢。
知能训练
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com