
1.相同温度下等物质的量浓度的下列溶液中,pH值最小的是 ( )
A. NH4Cl B. NH4HCO3 C. NH4HSO4 D. (NH4)2SO4
4、少数盐的离子间双水解反应较微弱,不能进行到底,故它们在水溶液中仍能较大量共存。如
典例剖析
[例1]已知K2HPO4溶液中HPO42-的水解程度大于电离程度,对于平衡:HPO42-+H2O H3O++PO43-,欲使溶液中c(HPO42-)、c(H3O+)、c(PO43-)三种离子浓度均减小,可采取的方法是
H3O++PO43-,欲使溶液中c(HPO42-)、c(H3O+)、c(PO43-)三种离子浓度均减小,可采取的方法是
A.加水 B.加热 C.加消石灰 D.加硝酸银
解析:首先抓住主要矛盾:HPO42-+H2O H2PO4-+OH-。对选项A,加水使溶液中的主要离子浓度减小,即c(OH-)减小c(H+)将变大,舍去;对选项B,加热时促进水解,使c(OH-)增大c(H+)减小必然导致c(PO43-)增大,舍去;对选项C,由于Ca(OH)2既能跟H+反应,又能跟HPO42-、PO43-反应,使它们的浓度下降,所以符合题意。对选项D,由于Ag+易跟
H2PO4-+OH-。对选项A,加水使溶液中的主要离子浓度减小,即c(OH-)减小c(H+)将变大,舍去;对选项B,加热时促进水解,使c(OH-)增大c(H+)减小必然导致c(PO43-)增大,舍去;对选项C,由于Ca(OH)2既能跟H+反应,又能跟HPO42-、PO43-反应,使它们的浓度下降,所以符合题意。对选项D,由于Ag+易跟
OH-反应生成AgOH↓使c(H+)增大,舍去。答案: C。
[例2]2002年全国,10)常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此
溶液中
A.c(HCOO-)>c(Na+) B.c(HCOO-)<c(Na+)
C.c(HCOO-)=c(Na+) D.无法确定c(HCOO-)与c(Na+)的关系
解析:甲酸和氢氧化钠溶液混合反应生成甲酸钠溶液,根据溶液中电荷守恒的关系,则所含的粒子Na+、HCOO-、H+、OH-存在的关系为c(HCOO-)+c(OH-)=c(Na+)+c(H+)。从
所得溶液pH=7,可知c(OH-)=c(H+),进而推知c(HCOO-)=c(Na+)。答案: C。
[例3] 下列说法正确的是( )
A. 酸式盐的水溶液一定显碱性。
B. 只要酸和碱的物质的量浓度和体积分别相等,它们反应后的溶液就呈中性。
C. 纯水呈中性是因为水中氢离子的物质的量浓度和氢氧根离子的物质的量浓度相等。
D. 碳酸溶液中氢离子的物质的量浓度是碳酸根离子的物质的量浓度的2倍。
解析:选项A不正确。像NaHCO3、NaHS、Na2HPO4等水解水溶液呈碱性;像NaHSO4、NaH2PO4等因电离水溶液呈酸性。
选项B是错误的。只有等元的强酸和强碱溶液,在物质的量浓度和体积相等的情况下,反应后溶液呈中性。若是其他情况溶液不一定呈中性。
选项C正确。H2O H++OH-,只要溶液中c(H+)=c(OH-)就呈中性,水也是如此.
H++OH-,只要溶液中c(H+)=c(OH-)就呈中性,水也是如此.
选项D错误。H2CO3是二元弱酸,其电离情况如下:
 答案:C
答案:C
[例4]某种一元强碱MOH溶液加入一种一元酸HA反应后,溶液呈中性,下列判断一定正确的是( )
A. 加入的酸过量 B. 生成的盐不水解
C. 酸和碱等物质的量混合 D. 反应后溶液中c(A_)=c(M+)
解析:一元强碱MOH与一元酸HA的反应为:MOH+HA=MA+H2O,反应后溶液中存在的离子有M+、H+、A-、OH-,因溶液呈中性,则c(H+)=c(OH-),又因为任何电解质溶液不显电性,则c(A_)=c(M+),所以选项D是正确的.由于HA是强酸还是弱酸没有说明,因此A、B、C的说法不一定正确。答案:D
[例5]为了得到比较纯净的物质,使用的方法恰当的是( )
A. 向Na2CO3饱和溶液中,通入过量的CO2后,在减压、加热的条件下,蒸发得NaHCO3晶体
B. 加热蒸发AlCl3饱和溶液得纯净的AlCl3晶体
C. 向FeBr2溶液中加入过量的氯水,加热蒸发得FeCl3晶体
D. 向FeCl3溶液里加入足量NaOH溶液,经过滤、洗涤沉淀,再充分灼烧沉淀得Fe2O3
解析:A不正确,因为NaHCO3加热要分解。
B、C也不正确,因为AlCl3与FeCl3在加热蒸发的情况下,水解趋于完成,分别发生下列反应:
Al3++3H2O Al(OH)3+3H+,2Al(OH)3
Al(OH)3+3H+,2Al(OH)3 Al2O3+3H2O
Al2O3+3H2O
Fe3++3H2O Fe(OH)3+3H+,2Fe(OH)3
Fe(OH)3+3H+,2Fe(OH)3 Fe2O3+3H2O
Fe2O3+3H2O
所以D是正确的。
[例6]现有电解质溶液:①Na2CO3 ②NaHCO3 ③NaAlO2 ④CH3COONa ⑤NaOH 且已知:
CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-。
(1)当五种溶液的pH相同时,其物质的量浓度由大到小的顺序是________(填编号)。
(2)将上述物质的量浓度均为0.1 mol·L-1的五种溶液,稀释相同倍数时,其pH变化最大
的是___________________(填编号)。
(3)在上述五种电解质溶液中,分别加入AlCl3溶液,无气体产生的是_______________(填
编号)。
(4)将上述①②③④这四种电解质溶液混合,发生反应的离子方程式为_____________。
解析:根据所给方程式可知Al(OH)3酸性比H2CO3弱。由于盐溶液的碱性强弱取决于阴离子的水解能力,故当pH相同时,越难水解的盐,浓度越大。
答案:(1)④>②>①>③>⑤ (2)⑤ (3)③④⑤(4)AlO2-+HCO3-+H2O=Al(OH)3↓+ CO32-
知能训练
3、下列离子间不发生双水解反应,而发生氧化还原反应:
Fe3++ S2- (少量)─ Fe3+ + S2- (大量)─
2、下列离子间不发生双水解反应,而发生复分解反应
Ag+ (Cu2+、Zn2+、Fe2+、Pb2+) + S2- -
Ag+ + CO32-( SO32- 、PO43-)-
1、下图实线相连的考虑双水解,虚线相连的不考虑双水解。
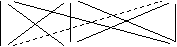 NH4+
Al3+ Fe3+(Fe2+、Cu2+)
NH4+
Al3+ Fe3+(Fe2+、Cu2+)
S2- CO32- AlO2-(CH3COO-)
9、 特殊盐水解程度大原则
例如:1mol·L-1Na2S溶液,Na2S的水解度为90%。0.1mol·L-1的Na2S溶液中,Na2S的水解度几乎是100%。在这个溶液中已水解离子的浓度或水解产物的浓度大于未水解离子的浓度。在Na2S溶液中有如下关系:
c (Na+)>c (OH-)> cHS-)>c (S2-)> c (H+) 10、缓冲溶液离子关系原则
能抵抗外加少量酸、碱或稀释,而本身pH值不发生显著变化的溶液称为缓冲溶液。如HAc-NaAc缓冲溶液。向这个溶液中加入少量强酸时,H+便同溶液中的Ac-结合生成HAc,使HAc的电离平衡向左移动。因此,达到新平衡时H+的浓度不会显著增大,即pH值不会显著变化。如果在该溶液中加入少量强碱时,所加入的OH-与溶液中的H+结合生成H2O。这就破坏了HAc的电离平衡,使其平衡向右移动,以补充H+浓度的减小。
由HAc和NaAc溶液的电离方程式可推知:一元弱酸和弱酸盐的缓冲溶液当酸的物质的量浓度等于碱的,H+浓度大于1×10-7mol·L-1,即溶液的pH<7,C(H+)>C(OH-)。因此,在HAc-NaAc缓冲溶液中存在以下关系: c (Ac-)>c (Na+)>c (H+)>c (OH-) c (Na+)=c (Ac-)+c (OH-)-c (H+) 另如在1.0mol·L-1NH3·H2O和1.0mol·L-1NH4Cl缓冲溶液中,存在关系:
c (NH4+)>c (Cl-)>c (OH-)>c (H+) c (NH4+)= c (Cl-)+c (OH-)-c (H+)
8、 离子效应影响原则
该原则是指由于与平衡有关的离子的存在,导致平衡移动的程度的差异,决定了离子浓度的大小,适用于通过平衡移动的程度比较溶液中离子浓度大小的题型。
例如:某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离;
H2A H++HA- HA-
H++HA- HA- H++A2-
已知相同浓度时的电离程度是第一步电离大于第二步电离,设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填写代号):
(1)c (H+)最大的是_________,最小的是_________。
(2)c(H2A)最大的是________,最小的是_________。
(3)c(A2-)最大的是_________,最小的是_________。
参考答案:(1)A;D。(2)C;D。(3)D;A。
H++A2-
已知相同浓度时的电离程度是第一步电离大于第二步电离,设有下列四种溶液:
A、0.01mol/L的H2A溶液
B、0.01mol/L的NaHA溶液
C、0.02mol/L的HCl与0.04mol/L的NaHA溶液等体积混合液
D、0.02mol/L的NaOH与0.02mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填写代号):
(1)c (H+)最大的是_________,最小的是_________。
(2)c(H2A)最大的是________,最小的是_________。
(3)c(A2-)最大的是_________,最小的是_________。
参考答案:(1)A;D。(2)C;D。(3)D;A。
7、 物料、电荷守恒结合原则
该原则是指同时运用电荷守恒、物料守恒比较溶液中复杂的离子分子浓度关系的题型。可通过两守恒式加减得新的关系式。
例如:在0.10mol·L-1的Na2CO3溶液中,据电荷守恒可得:
(1)c(Na+)+c (H+)=2 c (CO32-)+c (HCO3-)+c (OH-)
据物料守恒可得
(2)c (Na+)= c (HCO3-)+2 c (H2CO3)+ 2 c (CO32-)
(2)-(1)得:c (OH-)= c (H+)+ c (HCO3-)+ 2 c (H2CO3)
6、 以水解为主原则
当某弱酸、弱碱很弱,该酸与其强碱盐等体积等浓度混合时,以水解为主显碱性。也指除NaHSO3、NaH2PO4以外的多元弱酸强碱的酸式盐以水解为主,显碱性。
例如: 0.10mol·L-1HCN与0.10mol·L-1NaCN的混合液中有如下关系:
c (HCN)> c (Na+)> c (CN-)> c (OH-)> c (H+)
5、 以电离为主原则
该原则是指一元弱酸(HA)与该弱酸的强碱盐(NaA)等体积等浓度混合时,因HA的电离程度及A-的水解程度均较小,溶液呈酸性,以电离为主。
例如:0.10mol·L-1的CH3COOH 与0.10mol·L-1的CH3COONa等体积的混合液中有如下关系:
[CH3COO-]> C(Na+)>[CH3COOH] > C(H+)>[OH-]
而在0.10mol·L-1的NaHSO3的溶液中,由于电离大于水解,溶液显酸性,则有如下关系:
C(Na+)>[HSO3-]> C(H+)>[ SO32-]>[OH-]
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com