
3.下列各组元素中,按最高正价递增顺序排列的是
A.F、Cl、Br、I B.K、Mg、C、S
C.C、N、O、F D.Li、Na、K、Rb
2.已知1-18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是
A. 质子数c>b B. 离子的还原性Y2->Z-
C. 氢化物的稳定性H2Y>HZ D. 原子半径X<W
1.元素性质呈周期性变化的原因是
A.相对原子质量逐渐增大 B.核电荷数逐渐增大
C.核外电子排布呈周期性变化 D.元素的化合价呈周期性变化
5、氨基酸的两性
氨基酸分子既有酸性的羧基,又有碱性的氨基,因此和酸碱均能反应生成盐,是一种两性化合物。而且氨基酸分子中的氨基与羧基还可形成内盐。氨基酸的水溶液中,存在如下平衡:

在强酸性溶液中,氨基酸以阳离子形式存在;在强碱性溶液中,则主要以阴离子形式存在;氨基酸在一般情况下不是以游离的羧基或氨基存在的,而是两性电离,在固态或水溶液中形成内盐:
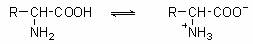
典例剖析
[例1]X和Y两元素的阳离子具有相同的电子层结构,X元素的阳离子半径大于Y元素的阳离子半径;Z和Y两元素的原子核外电子层次相同,Z元素的原子半径小于Y元素的原子半径。X、Y、Z三种元素原子序数的关系是
A、X>Y>Z B、Y>X>Z C、Z>X>Y D、Z>Y>X
解析:根据原子序数和元素周期律推测原子和离子半径大小,这是正向思维。而本题是已知原子和离子半径的大小,要判断原子序数大小的关系,这是逆向思维。已知电子层结构相同的阳离子,核电荷数大的则半径小,具有相同的电子层数的原子,随着原子序数增大,原子半径递减。根据题意,X元素的阳离子半径大于Y元素的阳离子半径,则X的原子序数小于Y的原子序数;Z和Y元素的原子核外电子层数相同,且Z元素的原子半径小于Y元素的原子半径,则Z元素的原子序数大于Y元素。由此得出三种元素原子序数的关系为Z>Y>X,答案:D。
[例2]已知铍(Be)的原子序数为4。下列对铍及其化合物的叙述中,正确的是
A、铍的原子半径大于硼的原子半径 B、氯化铍分子中铍原子的最外层电子数是8
C、氢氧化铍的碱性比氢氧化钙的弱 D、单质铍跟冷水反应产生氢气
解析:因为同周期元素原子半径从左到右递减,所以A正确;BeCl2中Be的最外层电子数为2,B错误;同主族元素从上到下金属性增强,最高价氧化物对应水化物碱性增强,C正确;Mg不与冷水反应,而Be的金属性比镁弱,与冷水反应更难,D错误。答案:A、C
[例3]下表是元素周期表的一部分,表中所列的字母分别表示一种化学元素

⑴下列 (填写编号)组元素可能都是电的良导体。
①a、c、h ②b、g、k ③c、h、l ④d、e、f
⑵如果给核外电子足够的能量,这些电子便会摆脱原子核的束缚而离去。核外电子离开该原子或离子所需要的能量主要受两大因素的影响:
A、原子核对核外电子的吸引力;B、形成稳定结构的倾向
(2)下表是一些气态原子失去核外不同电子所需的能量(KJ/mol):

①通过上述信息和表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量。_____________________。
②表中X可能为以上13种元素中的_______(填写字母)元素。用元素符号表示X和j形成化合物的化学式__________;Y是周期表中______族元素。
③以上13种元素中,__(填写字母)元素原子失去核外第一个电子需要的能量最多。
答案:(1)①④ (2)①Li原子失去一个电子后,Li+已经形成稳定结构,此时再失去一个电子很困难 ②aNa2O和Na2O2 ③IIIA或第三主族 ④m
[例4]制冷剂是一种易被压缩、液化的气体,液化后在管内循环,蒸发时吸收热量,使环境温度降低,达到制冷目的。人们曾经采用过乙醚、NH3、CH3Cl等作制冷剂,但它们不是有毒,就是易燃。于是科学家根据元素性质的递变规律来开发新的制冷剂。
据现有知识,某些元素化合物的易燃性、毒性变化趋势如下:
(1)氢化物的易燃性:
第二周期: > >H2O>HF
第三周期:SiH4>PH3> >
(2)化合物的毒性:PH3>NH3;H2S>H2O;CS2 CO2;CCl4>CF4,于是科学家们开始把注意力集中在含F、Cl的化合物上。
(3)已知CCl4的沸点为76.80C,CF4的沸点为-1280C,新制冷剂的沸点范围应介于其间。
经过较长时间的反复试验,一种新的制冷剂氟里昂CF2Cl2终于诞生了,其他类似的还可以是
。
(4)然而,这种制冷剂造成了当今的某一个环境问题是 。但求助于周期表中元素及其化合物 变化趋势来开发制冷剂的科学思维方法是值得借鉴的。(填写字母,多选扣分)
①毒性;②沸点;③易燃性;④水溶性;⑤颜色
A、①②③ B、②④⑤ C、②③④
解析:(1)根据元素周期律,非金属性越强,氢化物的稳定性越大.从题中的信息,知道第三周期的氢化物易燃性顺序为SiH4>PH3>H2S>HCl,因此很容易推出第二周期的氢化物的易燃性顺序为CH4>NH3>H2O、HF.(2)根据已知化合物的毒性:PH3>NH3,CCl4>CF4,自己创
造规律,得出“相同类型的化合物,相对分子质量越大,其化合物的毒性也越大”的结论,然后应用此规律,得出H2S>H2O;CS2>O2.答案:(1)CH4 NH3 (2)> > (3)CFCl3(或CF3Cl)(4)使大气臭氧层出现空洞 A。
知能训练
4、弱酸的酸式盐的两性
(1)实例:NaHCO3、NaHS、NaH2PO4、Na2HPO4等。
(2)本质:酸式盐的阴离子在水中亦存在两个平衡:
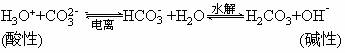
所以它们均既能与强酸反应又能与强碱反应,如:
NaHS+HCl==NaCl+H2S↑ NaHS+NaOH==Na2S+H2O
3、Zn(OH)2或H2ZnO2(锌酸)的两性:
Zn(OH)2+2H+==Zn2++2H2O Zn(OH)2+2OH-==ZnO22-+2H2O
注意:Zn(OH)2可溶于氨水生成[Zn(NH3)4]2+。
2.Be(OH)2或H2BeO2(铍酸)的两性
与Al(OH)3相同Be(OH)2存在如下两性电离:
2H++BeO22-
 Be(OH)2
Be(OH)2  Be2++2OH-
Be2++2OH-
Be(OH)2+2H+==Be2++2H2O Be(OH)2+2OH-==BeO22-+2H2O
既能跟强酸(H+)反应,又能跟强碱(OH-)反应的化合物可称为两性化合物。包括两性氧化物、两性氢氧化物、弱酸的酸式盐以及氨基酸等。
1.铝、氢氧化铝、氧化铝的两性
(1)2Al+6 H+==2 Al3++3H2↑ 2Al+2OH-+2H2O==2AlO2-+3H2↑
(2)Al2O3+6H+==2Al3++3H2O Al2O3+2OH-=2AlO2-+H2O
(3)Al(OH)3既能与强酸反应又能与强碱反应:
Al(OH)3既能与强酸反应又能与强碱反应,说明Al(OH)3必须同时能电离出H+和OH-,即能发生“两性电离”:
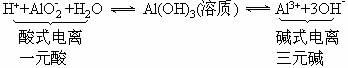
根据平衡移动原理,:当向上述平衡体系中加强酸,[H+]增大,同时又中和OH-使[OH-]下降,平衡向右移动,结果Al(OH)3逐渐溶解成Al3+;当向上述平衡中加强碱,[OH-]增大,同时又中和H+使[H+]下降,平衡向左移动,结果Al(OH)3固体逐渐溶解成为AlO2-。相关方程式:
Al(OH)3+3H+==Al3++3H2O(不能与H2CO3等弱酸反应)
Al(OH)3+OH-==AlO2-+2H2O(不能与氨水等弱碱反应)
21、最高正化合价不等于族序数的元素是O、Fe。
20、除H外,原子半径最小的元素是F。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com