
1.下列物质露置在空气中,质量会减轻的是 A.NaOH B.Na 2O2 C.无水CaCl2 D.Na2CO3·10H2O
案例1.胃舒平是一种常见的治疗胃病的药物。其主要的成分为Al(OH)3,试设计实验证明胃舒平含有Al(OH)3
|
实验目的 |
验证胃舒平药片中含有Al(OH)3 |
|
实验原理 |
Al(OH)3的两性 |
|
仪器及药品 |
研钵、试管、烧杯、漏斗、漏斗架、滤纸、玻璃棒、胶头滴管、NaOH溶液、大理石、启普发生器、胃舒平药片 |
|
步骤1 |
取3-5片药片,研碎,溶于水,观察 |
|
步骤2 |
向其中加入足量的NaOH溶液 |
|
步骤3 |
过滤 |
|
步骤4 |
向滤液中通入足量的CO2,观察 |
|
结论 |
|
|
备注 |
NaAlO2+CO2+2H2O====Al(OH)3↓+NaHCO3 |
案例2.红砖是一种常用的建筑材料,它是由黏土经高温烧制而成的。砖的红颜色就是由于含有氧化铁的缘故。设计实验证明红砖中含氧化铁。
|
实验目的 |
验证红砖中含有Fe2O3 |
|
实验原理 |
1.Fe3+遇KSCN溶液显红色 2.Fe3+遇NaOH溶液生成红棕色Fe(OH)3沉淀 |
|
仪器及药品 |
研钵、试管、烧杯、漏斗、漏斗架、滤纸、玻璃棒、胶头滴管、KSCN溶液、NaOH溶液、红砖、稀盐酸\KSCN溶液\NaOH溶液 |
|
步骤1 |
取一小块红砖,研碎,溶于水,观察,加入足量的稀盐酸,搅拌,静置 |
|
步骤2 |
过滤,并把滤液分成2份 |
|
步骤3 |
其中1份加入2滴KSCN溶液,观察 |
|
步骤4 |
向另1份加入足量的NaOH溶液,观察 |
|
结论 |
|
知能训练
5、Fe3+→Fe常发生在金属的热还原反应中。如高温下用CO还原铁矿石中的铁。
Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
铝热剂反应也是这种转化的实列。如:Fe2O3+2Al Al2O3+2Fe
Al2O3+2Fe
4、Fe3+→Fe2+需要较强的还原剂。如Fe、Zn、H2S(S2-)、KI(I-)、Na2SO3(SO32-)等,Cu虽不是强的还原剂,但因Fe3+具有较强的氧化性,可被Cu还原成Fe2+。
Cu+2FeCl3=CuCl2+2FeCl2;H2S+2FeCl3=2FeCl2+S↓+2HCl
2KI+2FeCl3=FeCl2+I2+2KCl
3、Fe2+→Fe,在金属活动性顺序表中排在Fe前的金属,如Zn、Al等,可以将Fe2+还原成Fe。
Zn+FeSO4=ZnSO4+Fe
注意:K、Ca、Na等活泼金属,由于它们在水溶液中不能存在,所以不能作为还原剂来完成Fe2+→Fe的转化。
2、2Fe→Fe2+需要较弱的氧化剂,如S、Cu2+(CuSO4)、H+(稀H2SO4、盐酸)等。
Fe+CuSO4=FeSO4+Cu ;Fe+2HCl=FeCl2+H2↑
注意Fe与O2、H2O的反应:
3Fe+2O2 Fe3O4 ;3Fe+4H2O(g)
Fe3O4 ;3Fe+4H2O(g) Fe3O4+4H2↑
Fe3O4+4H2↑
Fe3O4可以看作是由FeO、Fe2O3所组成的化合物,其中有1/3是Fe+、2/3是Fe3+。
铁是常见的还原剂,在参与化学反应时,一般可失去2e-或3e-而变成Fe2+离子或Fe3+离。铁元素的原子在化学反应中,当遇弱氧化剂(如S、H+、Cu2+、I2等)时,铁只能失去最外层的两个电子,而生成+2价铁的化合物,当遇到强氧化剂(如Cl2、Br2、HNO3等)时,铁原子可以再失去次外层上的一个电子而生成+3价铁的化合物,Fe、Fe2+、Fe3+形成三角关系:
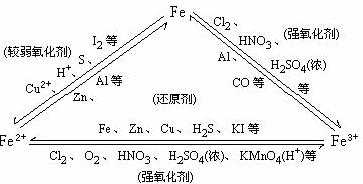
1、Fe→Fe3+和Fe2+→Fe3+需要强的氧化剂。如O2、Cl2、Br2、HNO3(浓、稀)、H2SO4(浓)、KMnO4(H+)溶液等。
2Fe+3Cl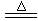 2FeCl3 ; Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;
2FeCl3 ; Fe+4HNO3(稀)=Fe(NO3)3+NO↑+2H2O;
4Fe(OH)2+2H2O+O2=4Fe(OH)3 ; 2FeCl2+Cl2=2FeCl3。
3.焰色反应
______________________为焰色反应。
焰色反应应如何操作? ________________________________________。
典型例题剖析
[例1](2002年江苏综合,24)等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加等质量的铝,生成氢气的体积比为5∶6,则甲、乙两烧杯中的反
应情况可能分别是
A.甲、乙中都是铝过量 B.甲中铝过量、乙中碱过量
C.甲中酸过量、乙中铝过量 D.甲中酸过量、乙中碱过量
解析:某物质的量的硫酸(甲)和氢氧化钠(乙)溶液分别与等质量的铝反应,生成氢气体积比即物质的量之比为n(甲)∶n(?乙)=5∶6
甲:2Al + 3H2SO4====Al2(SO4)3+3H2↑
 mol 5 mol 5
mol
mol 5 mol 5
mol
乙:2Al + 2NaOH+2H2O====2NaAlO2+3H2↑
4 mol 4 mol 6 mol
分析可知:甲中铝过量4 mol- mol=
mol=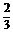 mol,乙中氢氧化钠过量5 mol-4
mol=1 mol。
mol,乙中氢氧化钠过量5 mol-4
mol=1 mol。
答案: B。
思维启迪(1)相同质量的镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积比是________。(2)相同物质的量的镁、铝分别与足量盐酸反应,在相同条件下产生氢气的体积比是_______。(3)若产生相同物质的量的氢气,所需镁、铝的质量比是____ (4)若产生相同体积(同温同压)的氢气,所需镁、铝的物质的量之比是________ 。
答案: (1)3∶4 (2)2∶3 (3)4∶3 (4)3∶2
[例2] 今用铝、稀硫酸和氢氧化钠溶液为原料,在实验室制备一定量的氢氧化铝。可分别采用如下化学方程式所表示的两种方法:
①2Al + 3H2SO4====Al2(SO4)3+3H2↑
Al2(SO4)3+6NaOH====2Al(OH)3↓+3Na2SO4
②2Al+2NaOH+2H2O====2NaAlO2+3H2↑
2NaAlO2+H2SO4+2H2O====2Al(OH)3↓+Na2SO4
(1)上述哪一种方法比较节约试剂?
(2)原料相同,请设计一种更为节约试剂的方法(以方程式表示,并说明可以节约试剂的根据)。
解析:(1)Al既可以跟稀H2SO4,也可以跟NaOH溶液反应,Al溶解并放出H2。溶解后如果再用NaOH溶液或H2SO4处理,实际上是调节溶液的pH,因为铝元素均存在于Al(OH)3沉淀中。先用酸,后用碱,还是先用碱,后用酸,都是可行的,但是耗用的酸、碱的量却不同。同样是制备2 mol Al(OH)3,前者需2 mol Al、3 mol H2SO4、6 mol NaOH,而后者只需2 mol Al、1 mol H2SO4、2 mol NaOH。显然,后者节约了酸、碱试剂。
(2)通过观察,发现第一种方法中第一步生成的是Al2(SO4)3,溶液呈酸性,所以要用较多的NaOH。第二种方法中,第一步生成的是NaAlO2,溶液呈碱性,所以要有较多的H2SO4。因此,设想是否能用呈酸性的Al2(SO4)3和呈碱性的NaAlO2混合反应制备Al(OH)3呢?实验说明上述设想可行。即将第一种方法和第二种方法联立起来,得到第三种方法。其化学方程式如下:
2Al+3H2SO4====Al2(SO4)3+3H2↑
2Al+2NaOH+2H2O====2NaAlO2+3H2↑
Al2(SO4)3+6NaAlO2+12H2O====8Al(OH)3↓+3Na2SO4
由这些反应式,可算得当制备2 mol Al(OH)3时需用2 mol Al、3/4 mol H2SO4、3/2 mol NaOH,比第一种和第二种方法使用的原料均少,确实节约了原料。
[例3]准确称取6克铝土矿样品(含Al2O3、Fe2O3、SiO2)放入盛有100ml某浓度的硫酸溶液的烧杯中,充分反应后过滤,向滤液中加入10ml的NaOH溶液,产生的沉淀的质量m与加入NaOH溶液的体积V的关系如图所示。请填空回答:
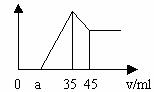
(1)H2SO4溶液的物质的量浓度为 ;
(2)a=2.3,用于沉淀铁离子,消耗的体积是 ,铝土矿中各组成成分的质量分数:Al2O3为 ,Fe2O3为 ,SiO2为 。
(3)a值的范围应是 ,在这个范围内,a值越大, 的质量分数越小
解析:(1)由图像可知当加入35mlNaOH溶液时,滤液中过量的硫酸被中和,且Fe3+、Al3+全部沉淀,用整体法分析反应的过程,消耗H离子的物质的量等于OH离子的物质的量,得硫酸的物质的量浓度为:0.035×10×1/2/0.01=1.75(mol/l)
(2)用隔离法考查:从溶解Al(OH)3消耗,推知用于Al3+沉淀所消耗的NaOH溶液30ml,则
沉淀Fe3+所消耗的NaOH溶液为:35-30-2.3=2.7(ml)再根据反应前后各元素的原子的物质的量不变,可分别求出Al2O3,Fe2O3的物质的量为:85%、12%。
(3)用隔离法考查:沉淀Fe3+所消耗的NaOH溶液为35-30-a=(5-a)ml不难看出a值肯定应小于5,假设铝矿土样品中不含SiO2,则可求出a的最小值为1.64ml。故a的取值范围为:1.64<a<5。
[例3]Fe(OH)2由于在空气中易被氧化,制取时很难观察到白色沉淀现象,只能看到灰绿色,采用图装置使用Fe,H2SO4(稀),NaOH溶液可在还原性气氛中制取Fe(OH)2白色沉淀,且较长时间内不变色,其中C为弹簧夹。(提示:还原性气氛如氢气环境)
(1)则锥形瓶A中应加入的药品为________________________,
(2)锥形瓶B中应加入的药品为________________________.
(3)容器A中的反应开始后,请设计后续操作步骤完成的制备,并说明每步操作理由和现象。
__________________________________________________________________________。

解析:A中发生:Fe + H2SO4 = FeSO4 + H2↑。H2排尽装置和溶液中的氧气,形成还原性气氛。关闭弹簧夹C时,A中压强增大,使得反应生成的FeSO4溶液进入B,而和NaOH反应,生成Fe(OH)2沉淀,由于没有了氧化性气氛,Fe(OH)2沉淀得以保存较长时间。否则将发生4Fe(OH)2 + O2 + 2H2O = 4Fe(OH)3 。
答案:(1)铁和稀硫酸;(2)氢氧化钠溶液。(3)①打开弹簧夹C;A中气体由导管进入B,B中有气泡;目的是为了排尽装置和溶液中的氧气,形成还原性气氛。②过一段时间,关闭弹簧夹C;A中溶液经导管进入B,B中有白色沉淀生成;因为此时A中压强增大,使得反应生成的FeSO4溶液进入B,而和NaOH反应,生成Fe(OH)2沉淀。
疑难点拨
2.三价铁的氧化性
(1)Fe3+的检验方法______________________:
(2)Fe3+的氧化性:在盛有2 mL FeCl3溶液的试管中,加入少量铁粉,振荡试管。充分反应后,滴入加几滴KSCN溶液,观察并记录实验现象。再加入几滴氯水,又发生了什么变化?
|
加 入 |
现 象 |
反应的化学方程式 |
|
铁粉,KSCN溶液 |
|
2FeCl3+Fe====3FeCl2 |
|
加入氯水,振荡 |
|
2FeCl2+Cl2====2FeCl3 |
思考:如何除去FeCl3溶液中少量的FeCl2,以及 FeCl2溶液中少量的 FeCl3?
(3)铝盐和铁盐的净水作用
1.碳酸钠和碳酸氢钠性质对比
(1)Na2CO3和NaHCO3在水中的溶解性:_______________;
(2) Na2CO3和NaHCO3水溶液碱性:______________;
(3)与同浓度盐酸反应剧烈程度:______________;
思考:如何鉴别Na2CO3和NaHCO3两种溶液?__________________。
(4)热稳定性:_________
(5)相互转化:碳酸钠和碳酸氢钠作为碳酸的正盐和对应的酸式盐,在一定条件下可相互转化:
如:Na2CO3+H2O+CO2==____________;
Na2CO3+HCl(少量)==____________;
NaHCO3+NaOH==____________;
NaHCO3 ____________。
____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com