
1. 容器若为恒定容器,在容器内充入惰性气体,则化学反应速率_____(加快,不变,减慢),原因是_________ 。
3、压强对化学反应速率的影响
思考1:2L密闭容器中,投入5molN2,8molH2,在催化剂存在的条件下发生反应,2min 时,测得容器内生成NH34mol,若将容器的体积减小为原来的一半,其他条件不变,同样生成4molNH3所花费的时间___2min(<,=,>,),为什么?
思考2:在室温条件,通过什么途径可以改变容器体积?
结论:有气体参与的反应,压强增大,化学反应速率____
思考3:参加反应的物质是固体,液体或溶液时,压强对反应速率___影响?(填有,无)
例3.NO和CO都是汽车尾气中的有害物质,它们能缓慢地起反应,生成N2和CO2,对此反应的下列叙述中正确的是( )
A、 使用催化剂不能加快反应速率 B、 降低压强能加快反应速率
C、 升高温度能加快反应速率 D、 改变压强对化学反应速率无影响
解析:根据外界条件对反应速率影响的分析:使用催化剂一般能加快反应速率;对气体反应来说,压强的改变对反应速率有影响,增大压强会加快反应速率,减小压强会减慢反应速率;升高温度会加快反应速率,降低温度会减慢反应速率,据此可判断A、B、D说法错误,选项C说法正确。
探讨:N2 + 3H2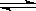 2NH3反应在密闭容器中进行
2NH3反应在密闭容器中进行
2、温度对化学反应速率的影响:温度升高,化学反应速率__________.
例2. 设C+CO2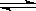 2CO(正反应为吸热反应),反应速率为V1;N2+3H2
2CO(正反应为吸热反应),反应速率为V1;N2+3H2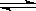 2NH3(正反应为放热反应),反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
2NH3(正反应为放热反应),反应速率为V2,对于上述反应,当温度升高时,V1和V2的变化情况为
A 同时增大 B 同时减小 C V1增大,V2减小 D V1减小,V2增大
解析:当温度升高时,无论正反应是吸热还是放热,化学反应速率都将增大,只不过增大的程度一个小一些,一个大些。本题易误解为:升高温度,C+CO2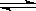 2CO(正反应为吸热反应)反应速率减小,原因是“正反应为吸热反应”。选 (A)。
2CO(正反应为吸热反应)反应速率减小,原因是“正反应为吸热反应”。选 (A)。
反思:一个化学反应的反应速率固然跟它的放热、吸热有关,但升高温度都将使化学反应速率增大。
内因
影响反应速率的外因主要有
1、浓度对化学反应速率的影响:反应物浓度越大,化学反应速率________.
例1.反应3Fe(s)+4H2O(g)
 Fe3O4(s)+
4H2(g),在一可变容积的密闭容器中进行,下来条件的改变对其反应速率几乎无影响的是( )
Fe3O4(s)+
4H2(g),在一可变容积的密闭容器中进行,下来条件的改变对其反应速率几乎无影响的是( )
A.增加铁的量 B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.压强不变,充入N2使容器体积增大
解析:A中Fe为固体,增多其用量对反应速率无影响,因为固体的浓度为定值;B中将体积缩小,压强增大,水蒸气和氢气的浓度增大,反应速率加快;C中恒容充入N2,N2不参与反应,H2和水蒸气的浓度不变,因此对反应速率无影响;D中压强不变充入N2,体积增大,N2和水蒸气的浓度减小,故反应速率减慢。答案:A、C
20.在由铜片、锌片和200 mL稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3.36 L(标准状况)的H2时,硫酸恰好用完,则:
(1)产生这些气体消耗的锌的质量是多少?
(2) 通过导线的电子的物质的量是多少?
19.有A、B两种金属分别与盐酸反应,产生氢气的速率相近。怎样设计一个实验证明A、B两种金属的活动性?(画出实验装置图)
18、请设计一个原电池,其总反应为:Zn + 2FeCl3 = ZnCl2 + 2FeCl2。
17、市场上出售的“热敷袋”其中主要成分是铁屑、碳粉和少量的NaCl、水等.热敷袋在启用前用塑料袋使之与空气隔绝,启用时,打开塑料袋轻轻揉搓,就会放出热量,使用完后,会发现袋内有许多铁锈生成,回答:
(1)热敷袋放出的热量来源于 放出的热量.
(1)碳粉的作用是 .
(3)加入NaCl的作用是 .
(4)写出有关的电极反应式和化学方程式 .
16、某同学想测定A、B、C三种金属活动顺序,他把这三种金属放到相同物质的量浓度的盐酸中,反应速率都较慢,不易分辨出三者差异,现只有盐酸一种化学试剂,应该用什么方法迅速测出三种金属的活动性顺序?
15、将锌片和铜片插入某种电解质溶液,锌片和铜片用导线相连,形成原电池装置。
(1)若电解质溶液是稀硫酸,则发生氧化反应的是 极(“锌”、“铜”),铜极发生的反应是 ,该电池的总反应方程式是 。(2)若电解质溶液是硫酸铜溶液,在导线中电子是由 极流向 极,铜极上反应的电极反应方程式是 ,该电池总反应方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com