
6.容积固定的2L密闭容器中进行的某一可逆反应
A(气)+2B(气) 2C(气)
2C(气)
以B的物质的量浓度改变表示的反应速度υ正,υ正、υ逆与时间的关系图如所示。已知反应速率υ的单位为mol·L-1·s-1,则图中阴影部分的面积可表示( )。
A、A的物质的量浓度的减少 B、B的物质的量浓度的减少
C、C的物质的量增加 D、B的物质的量减少

5.下表中是各组反应的反应物和反应温度,反应刚开始时,放出H2速率最快的是( )
|
编号 金属(粉末状) 酸的浓度及体积
反应温度 (mol) (℃) |
|
A Mg,0.1 6 mol·L-1 硝酸10mL
60 B Mg,0.1 3 mol·L-1 盐酸10mL 60 C Fe,0.1 3 mol·L-1L 盐酸10mL 60 D Mg,0.1 3 mol·L-1 硫酸10mL 60 |
4.把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )。
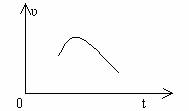
A、 ①④ B、③④ C、①②③ D、②③
3.设
C+CO2  2CO-Q1,反应速率为υ1;N2+3H2
2CO-Q1,反应速率为υ1;N2+3H2  2NH3+Q2,反应速率为υ2。对于上述反应,当温度升高时,υ1和υ2的变化情况为( )。
2NH3+Q2,反应速率为υ2。对于上述反应,当温度升高时,υ1和υ2的变化情况为( )。
A、同时增大 B、同时减小 C、υ1增大,υ2减小 D、υ1减小,υ2增大
2.NO和CO都是汽车尾气里的有害物质,它们能缓慢地起反应生成氮气和二氧化碳气体:2NO+2CO=N2+2CO2,对此反应,下列叙述正确的是( )
A、使用催化剂能加快反应速率 B、改变压强对反应速率没有影响
C、冬天气温低,反应速率降低,对人体危害更大
D、无论外界条件怎样改变,均对此化学反应的速率无影响
1.一般都能使反应速率加快的方法是( )。
①升温;②改变生成物浓度;③增加反应物浓度;④加压
A、①②③ B、①③ C、②③ D、①②③④
3.已知氯酸钾和亚硫酸氢钠发生氧化还原反应,生成-1价的氯和+6价的硫的化合物,反应速率v和反应时间t的关系如图所示。
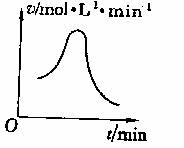
已知这个反应速率随溶液中氢离子浓度增大而加快,试解释:
(1)反应开始时,反应速率加快的原因是 。
(2)反应后期,反应速率下降的原因是 。
解析:由题意可知,该反应的速率随着c(H+)的增大而加快,因此必须把反应过程中c(H+)的变化及反应物浓度的变化结合考虑,才能得出该题的正确答案。该反应的化学方程式是:2KClO3+6NaHSO3=3Na2SO4+2KCl+3H2SO4。开始时,随着反应的进行,不断有强酸H2SO4生成,c(H+)不断增大,反应速率也随之增大。随着时间的延长,KClO3和NaHSO3被消耗而愈来愈少,浓度愈来愈小,因此反应速率下降。
答案:(1)开始时,随着反应的进行,不断有强酸H2SO4生成, ClO3-+3HSO3-=3SO42-+Cl-+3H+,c(H+)不断增大,反应速率也随之增大。
(2)随着时间的延长,KClO3和NaHSO3被消耗而愈来愈少,H++ HSO3-=SO2↑+H2O,c(H+)浓度愈来愈小,因此反应速率下降。
知能训练
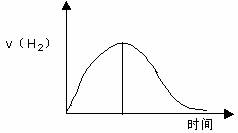
2、下图为将Zn投入一定浓度一定体积的H2SO4中,解释图象的成因.(纵坐标为H2的生成速率)
4、催化剂
催化剂定义:________________________ __________?
请例举几例催化剂对化学反应速率影响的实例.
探讨:1、如何加快铁与盐酸的反应速率?
2. 容器若为恒压容器,在容器内充入惰性气体,则反应速率(加快,不变,减慢)_____,原因是________ 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com