
1、①相同物质的量浓度的酸溶液,pH值顺序为多元强酸 < 一元强酸 < 弱酸。
②相同物质的量浓度的碱溶液,pH值顺序为多元强碱 > 一元强碱 > 弱碱。
③pH值相同的酸溶液,则酸的物质的量浓度顺序为弱酸 > 一元强酸 >多元强酸。
④pH值相同的碱溶液,则碱的物质的量的浓度顺序为弱碱 > 一元强碱 > 多元强碱。
4、下面是用标准酸滴定待测碱而引起的结果变化情况 :
|
实验操作情况 |
对c碱的影响 |
|
①开始滴定时滴定管尖嘴处留有气泡 |
偏 |
|
②读数开始时仰视,终止时俯视 |
偏 |
|
③到滴定终点时尚有一滴酸挂在滴定管尖嘴外而未滴入锥瓶 |
偏 |
|
④洗净的酸管未用标准液润洗 |
偏 |
|
⑤洗净的锥瓶用待测碱润洗 |
偏 |
|
⑥不小心将标准液滴至锥瓶外 |
偏 |
|
⑦不小心将待测碱液溅至锥瓶外 |
偏 |
|
⑧滴定前向锥形瓶中加入10 mL蒸馏水,其余操作正常 |
|
疑难点拨
3、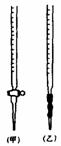 用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确选项
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,参考右图,从下表中选出正确选项
|
|
锥形瓶中的溶液 |
滴定管中的溶液 |
选用指示剂 |
选用滴定管 |
|
A |
碱 |
酸 |
石蕊 |
(乙) |
|
B |
酸 |
碱 |
酚酞 |
(甲) |
|
C |
碱 |
酸 |
甲基橙 |
(甲) |
|
D |
酸 |
碱 |
酚酞 |
(乙) |
2、下列实验中,直接采用沾有水滴的仪器,对实验结果没有影响的是( )
A.氨的喷泉实验:烧瓶 B.实验制取氧气:试管C.中和滴定:锥形瓶 D.中和滴定:滴定管
1、某学生中和滴定实验的过程如下:(a)取一支碱式滴定管,(b)用蒸馏水洗净,(c)加入待测的NaOH溶液,(d)记录液面刻度的读数,(e)用酸式滴定管精确放出一定量标准酸液,(f)置于未经标准酸液润洗的洁净锥形瓶中,(g)加入适量蒸馏水,(h)加入2滴酚酞试液,(i)开始滴定,边滴边摇荡,(j)边注视滴定管内液面变化,(k)当小心滴到溶液由无色变成粉红色时,即停止滴定。(l)记录液面刻度的读数。(m)根据滴定管的两次读数得出NaOH溶液的体积为22 mL。指出上述实验过程中的错误之处(用编号表示) 。
2、酸碱中和滴定实验
实验仪器:
实验药品: 、 、
实验步骤: ⑴查:检查两滴定管是否漏水和堵塞;
⑵洗:
⑶盛:调:用小烧杯分别取盐酸、氢氧化钠溶液注入酸、碱滴定管中,并赶走气泡,调节滴定管中液面高度,在“ ”ml之间,并记下读数。
⑷取:从碱式滴定管中放出25.00mL氢氧化钠溶液于锥形瓶中,滴入2滴酚酞试液,将锥形瓶置于酸式滴定管下方,并在瓶底衬一张白纸。
⑸滴定:左手 ,右手 ,边滴入盐酸,边不断摇动锥形瓶,眼睛 。
⑹记:当看到加一滴盐酸时,锥形瓶中溶液红色突变无色时,停止滴定,准确记下盐酸读数,并准确求得滴定用去的盐酸体积。
⑺算:整理数据进行计算。
[练习]
1、酸碱中和滴定概念:
叫做酸碱中和。滴定的原理:n元酸与 n′元碱恰好完全中和时:n C酸 V酸 = n′C碱 V碱。如果用A代表一元酸,用B代表一元碱,可以利用下列关系式来计算未知碱(或酸)的物质的量浓度:CB=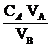
4、溶液混和后的pH值的计算
(1)强酸与强酸溶液混和,先求 ,再求PH值
[H+]=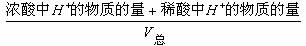
若等体积混和,且原溶液PH值相差≥2时,PH混≈
(2)强碱与强碱溶液混和,先求
,通过[H+]=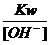 ,再求pH值。
,再求pH值。
[OH-]=
若等体积混和,且原溶液pH值相差≥2时,则PH混=
(3)强酸与强碱溶液混和:
①若酸过量:[H+]=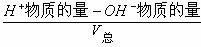
②若酸碱正好完全反应:pH=
③若碱过量则[OH-]=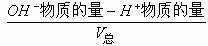 .再求[ H+]和PH值。
.再求[ H+]和PH值。
(4)未标明酸碱的强弱,如把pH=3与pH=11的溶液等体积混和后,若二者为强酸强碱pH= ;若为弱酸强碱,则 有余,pH ,若强酸弱碱混和则 有余,pH 。
3、测定pH值的常用方法
⑴酸碱指示剂
⑵pH试纸:使用方法
⑶pH计:最精确
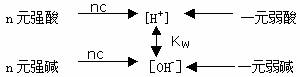
2、溶液浓度C mol/L、[H+],电离度α、pH值之间的关系
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com