
5. 常温下某溶液中水电离出的C(H+) = 1×10-13 mol/L,则下列说法中正确的是 ( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液中一定有C(OH-) = 0.1mol/L D.该溶液的pH值为1或13
4.能使水的电离平衡正向移动,而且所得溶液呈酸性的是 ( )
A.将水加热到100℃时,水的pH=6 B.向水中滴加少量稀硫酸
C.向水中滴加少量NaHCO3 D.向水中加入少量明矾晶体
3.pH定义为pH=-lg{c(H+)},pOH定义为pOH=-lg{c(OH-)},Kw表示25℃时水的离子积常
数,则弱酸性溶液中的c(H+)可表示为 ( )
A、Kw/pOH mol/L B、10pOH-14 mol/L C、10 14-pOH mol/L D、10-pOH mol/L
2.将1mol·L-1H2SO4溶液100mL与质量分数为10%的NaOH溶液50g混合均匀后,滴入甲基橙指示剂,此时溶液的颜色是 ( )
A.浅紫色 B.黄色 C.红色 D.无色
1.水是一种极弱的电解质,在室温下平均每n个水分子只有一个水分子能电离,则n是 ( )
A.1×10-4 B. 55.6×107 C. 1×107 D. 6.02×1021
2、有人曾建议用AG表示溶液的酸度(acidity arede),AG的定义为AG=lg([H+]/[OH
-])。下列表述正确的是
A、在25℃时,若溶液呈中性,则pH=7,AG=1
B、在25℃时,若溶液呈酸性,则pH<7,AG<0
C、在25℃时,若溶液呈碱性,则pH>7,AG>0
D、在25℃时,溶液的pH与AG的换算公式为AG=2(7-pH) (2002理科综合)
[例6]室温下将n体积pH=10和m体积pH=13两种NaOH溶液混合得pH=12的NaOH
溶液,则n:m=--------------
解析:此题是关于两种不反应的溶液混合后溶液pH值的计算,根据混合前后溶质(NaOH)量守
恒,列式求解
解答:pH=10 C(H+)=10-10mol/L C(OH-) =10-4mol/L
pH=13 C(H+)=10-13mol/L C(OH-) =10-1mol/L
pH=12 C(H+)=10-12mol/L C(OH-) =10-2mol/L
10-4·n + 10-1·m = (n+m) ×10-2
n :m = 100 :11
规律:有关混合溶液的pH计算,题设条件可千变万化,正向、逆向思维,数字与字母交替出现,但基本题型只有两种:(1)混合后不反应,(2)混合后反应。对于溶液的稀释,可将水作为浓度为0的溶液,仍属混合后不反应一类,这一类混合溶液的pH应介于两种溶液的pH之间,因而酸、碱溶液无论加多少水稀释,其最终pH均不可能等于纯水的pH(即常温不可能为7)。混合溶液pH的计算方法也很简单,即设法求出混合溶液的C(H+),若是溶液显碱性,则必须先求出溶液的C(OH-),然后再换算为C(H+)或按OH-量守恒列式求解。
[例7]25ºC,若10体积的某强碱溶液与1体积的某强酸溶液混合后,溶液呈中性,则混合之前,该碱的pH与强酸的pH之间该满足的关系是_______________________
解析:由题意知,本题为酸、碱混合后完全中和,根据中和反应的实质可知,酸中n(H+)与碱
中n(OH-)相等,故有C(H+)酸V酸 == C(OH-)碱V碱,由此关系列式可求得结果。
解答:设酸的pH为a,C(H+)酸=10-a,碱的pH为b,C(OH-)碱=10-14 / 10-b=10- (14 - b),因为混合后溶液呈中性,所以C(H+)酸V酸 == C(OH-)碱V碱
10-a ×V = 10 - (14 - b) ×10V = 10 - (13 - b) ×V
10-a = 10 - (13 - b)
两边取负对数:-lg10-a = -lg10 - (13 - b),a=13-b a+b=13
即酸的pH与碱的pH之和为13
点评:上面解法尽管可顺利地得出本题的解,但题中的酸碱体积比可以任意变换,则每一变换都得重新求解,这就启发我们能否找出酸、碱pH与两者体积比之间的关系呢?同时若混合后不显中性其关系又会怎样呢?将上面的解改为:
C(H+)酸V酸 == C(OH-)碱V碱
10-a ×V酸 = 10 - (14 - b) ×V碱
10-a·10-b=10-14·(V碱 / V酸)
两边取负对数得:a+b=14―lg(V碱 / V酸)
若混合后溶液显酸性____________________________。
若混合后溶液显碱性____________________________。
知能训练
一 选择题
1、计算中应注意的几个问题:
H2O H++OH-(正反应吸热),25°C时C(H+)=C(OH-)=10-7mol/L,水的离子积为10-14mol/L。理解水的离子积要注意三个方面:
H++OH-(正反应吸热),25°C时C(H+)=C(OH-)=10-7mol/L,水的离子积为10-14mol/L。理解水的离子积要注意三个方面:
(1)水的离子积与温度有关,因水的电离过程吸热,升温有利于水的电离,水的离子积增大。如:100°C时,水的离子积为10-12mol/L。
(2)水的离子积揭示了在任何水溶液中都存在水的电离平衡,都有H+和OH-共存,只是相对含量不同。
(3)水的离子积不仅适用于纯水,还适用于酸性溶液或是碱性溶液。且都有C(H+)水=C(OH-)水。如:酸性溶液中:{C(H+)酸+C(H+)水}·C(OH-)水=KW ;碱性溶液中:{C(OH-)碱+C(OH-)水}·C(H+)水= KW
例1 、把1mLPH=5的盐酸稀释至1L,此时溶液的PH是
A.6-7之间 B.7-8之间 C.8 D.7
解析:当盐酸稀释到PH=7时,再继续稀释仍PH=7,PH不可能再继续增大。
例2、把1mL0.1mol/L的H2SO4加水稀释成2L溶液,在此溶液中由水电离产生的H+,其浓度接近于
A. 1×10-4 mol/L B. 1×10-8 mol/L C. 1×10-11 mol/L D. 1×10-10 mol/L
解析:温度不变时,水溶液中氢离子的浓度和氢氧根离子的浓度乘积是一个常数。在酸溶液中氢氧根离子完全由水电离产生,而氢离子则由酸和水共同电离产生。当酸的浓度不是极小的情况下,由酸电离产生的氢离子总是远大于由水电离产生的(常常忽略水电离的部分),而水电离产生的氢离子和氢氧根离子始终一样多。所以,酸溶液中的水电离的氢离子的求算通常采用求算氢氧根离子。
稀释后C(H+) =(1×10-3L×0.1mol/L)/2L = 1×10-4mol/L,C(OH-) = 1×10-14/1×10-4 = 1×10-10 mol/L,答案:D。
例3、室温下,在PH=12的某溶液中,由水电离出的C(OH-)可能为
A.10-7mol/L B.10-6mol/L C.10-2mol/L D.10-12mol/L
解析:如果溶质是碱(可能是强碱也可能是弱碱),C(OH-)碱+(OH-)水=10-2mol/L,而C(OH-)水=C(H+)=10-14/10-2=10-12mol/L;如果溶质是强碱弱酸盐(如NaF),则F-与水电离产生的H+结合成弱电解质HF而促进了水的电离,溶液中的OH-完全来源于水的电离,即C(H+)水=C(OH-)水=10-2mol/L。答案为C、D。
例4、 某温度下,纯水中的C(H+)=2×10-7mol/L,则此时溶液的C(OH-)为 mol/L;若温度不变,滴入稀硫酸,使C(H+)=5×10-6mol/L,则C(OH-)= mol/L。
解析:任何温度下,纯水电离出的C(H+)=C(OH-),故C(OH-)为2×10-7mol/L;此时水的离子积为4×10-14,不管是酸性溶液还是碱性溶液,只要温度不变水的离子积就不变,则C(OH-)=8×10-9mol/L。
典例剖析
[例1](1)与纯水的电离相似,液氨中也存在着微弱的电离:2NH3 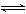 NH4++NH2-
NH4++NH2-
据此判断以下叙述中错误的是 ( )
A.液氨中含有NH3、NH4+、NH2-等微粒
B.一定温度下液氨中C(NH4+)·C(NH2-)是一个常数
C.液氨的电离达到平衡时C(NH3) = C(NH4+) = C(NH2-)
D.只要不加入其他物质,液氨中C(NH4+) = C(NH2-)
(2)完成下列反应方程式
①在液氨中投入一小块金属钠,放出气体____________________________。
②NaNH2溶于水的反应____________________________。
③类似于“H++OH-=H2O”的反应____________________________。
解析:此题要求掌握水自偶的实质(水分子电离产生的H+与H2O结合形成H3O+)以及水的电离平衡,并能迁移应用于对于NH3电离的认识:NH3分子电离产生H+和NH2-,H+与NH3结合生成NH4+,液氨电离产生等量的NH2-与NH4+,一定温度下离子浓度乘积为一常数;NH4+类似于H+,NH2-类似于OH-。具备上述知识后,就可顺利完成解题。
答案:(1)C(2)①2Na+2NH3=H2↑+2NaNH2②NaNH2+H2O=NaOH+NH3↑或NH2-+H2O=OH-+NH3↑③NH2-+NH4+ =2NH3↑或NH4Cl+NaNH2=2NH3↑+NaCl
[例2]某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(OH-) = ___________。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = ___________。
解析:由水电离产生的H+与OH-量始终相等,知纯水中C(H+) = C(OH-)。根据纯水中C(H+) 与C(OH-)可求出此温度下水的Kw的值,由Kw的性质(只与温度有关,与离子浓度无关),若温度不变,稀盐酸中Kw仍为此值,利用此值可求出盐酸中的C(OH-)。
答案:纯水中 C(OH-) = C(H+) = 2×10-7 mol/L Kw = C(H+)·C(OH-) = 2×10-7×2×10-7 = 4×10-14 稀盐酸中 C(OH-) = Kw / C(H+) = (4×10-14) / (5×10-6) = 8×10-9 mol/L
[例3] :某溶液中由水电离出来的C(OH-)=10-12mol/L,则该溶液中的溶质不可能是( )
A、HCl B、NaOH C、NH4Cl D、H2SO4
解析:由水电离反应式知:此溶液水电离产生的C(H+)=C(OH-) =10-12mol/L,若溶液中的H+全部来自水的电离,则此溶液显碱性,是因溶有碱类物质所致,若溶液中的H+不仅为水电离所产生,则此溶液显酸性,为酸性物质电离所致。NH4Cl不可能电离产生H+。解答:C
[例4]能促进水的电离,并使溶液中C(H+)>C(OH-)的操作是 ( )
(1)将水加热煮沸 (2)向水中投入一小块金属钠 (3)向水中通CO2 (4)向水中通NH3 (5)向水中加入明矾晶体 (6)向水中加入NaHCO3固体 (7)向水中加NaHSO4固体
A、(1)(3)(6)(7) B、(1)(3)(6) C、(5)(7) D、(5)
解析:本题主要考查外界条件对水的电离平衡的影响,请按如下思路完成本题的解:本题涉及到哪些条件对水的电离平衡的影响?各自对水的电离平衡如何影响?结果任何(C(H+)与C(OH-)相对大小)?归纳酸、碱、盐对水的电离平衡的影响。解答: D
[例5]、下列溶液,一定呈中性的是 ( )
A.由等体积、等物质的量浓度的一元酸跟氢氧化钠溶液混合后所形成的溶液
B.[H+]=1×10-7mol·L-1的溶液
C.pH=14-pOH 的溶液
D.pH=pOH 的溶液 (2000年化学试测题)
解析:此题要求将教材中定义pH方法迁移应用于表示pOH以及pH与pOH的关系,根据pH
的定义方法,可定义pOH= ―lgC(OH―),将室温下水的离子积的表达式C(H+)×C(OH-)=10―14两边取负对数,―lgC(H+)―lgC(OH―)= ―lg10―14,整理得pH+pOH=14。应用所得关系式分析可得D答案。
点评:pOH= ―lgC(OH―)、pH+pOH=14两个关系式及其应用均不在教学大纲和考纲范围内,我们不一定要掌握,但将教材中的知识、方法加以迁移应用,进行探究发现是教学大纲和考纲提出的能力要求。此题作为全国高考化学测试题具有重要的指导意义,值得大家认真去领悟,在随后的2001年上海高考题以及2002年全国理科综合高考题中又出现了类似的题目。
[练习]1、为更好地表示溶液的酸碱性,科学 家提出了酸度(AG)的概念,AG=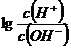 ,则下列叙述正确的是
,则下列叙述正确的是
A、中性溶液的AG=0 B、酸性溶液的AG<0
C、常温下0.lmol/L氢氧化钠溶液的AG=12
D、常温下0.lmol/L盐酸溶液的AG=12( 2001年上海)
在计算溶液加水稀释后,所得溶液的pH时,应注意以下三点:
(1)要审清题意,注意是强酸、强碱,还是弱酸、弱碱。
(2)要注意在计算碱性溶液的pH时,一定要先计算出原溶液的[OH-],再根据稀释后溶液的[OH-]计算出[H+]或pOH后,再算溶液的pH。
(3)对于强酸溶液体积稀释原来的10n倍时,则所得溶液的pH增大n个单位(注意pH一定小于7)。对于强碱溶液体积稀释到原来的10n倍时,则溶液的pH减小n个单位(最后结果不得小于或等于7)。
例如①将pH=2的盐酸稀释100倍后,溶液的pH等于4。②将pH=13的NaOH溶液稀释1000倍后,溶液的pH=10。③将pH=8的氢氧化钡溶液稀释100倍后,溶液的pH接近于7,但还是略大于7。
3、强碱与强碱、强酸与强酸等体积混合
例1、将pH=1和pH=3的盐酸等体积混合后,求其pH值。
∵[H+]混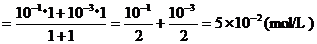

∴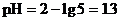
经验规律:两者pH值的差值≥2的两种强酸,等体积混合液的pH值等于“原小值+0.3”。如pH=1与pH=4、5、6的盐酸混合,pH值均为:1+0.3=1.3。
例2、将pH=12和pH=10的NaOH溶液等体积混合后溶液的pH值。
∵[OH-]混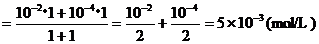

∴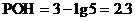
故PH=14-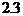 =11.7
=11.7
经验规律:两者pH值的差值≥2的两种强碱,等体积混合液的pH值等于“原大值-0.3”。如pH=12与pH=10、9、8的NaOH混合,pH值等于:12-0.3=11.7。
2、稀释定律:稀释前后,溶质的物质的量不变(溶质的质量也不变),即C2 =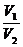 C1 。
C1 。
注意:稀释前后,溶质所含离子的量不一定守恒。
对强电解质而言:c(离子)1V1=c(离子)2V2
对弱电解质而言:c(离子)1V1≠c(离子)2V2
|
pH值的变化 |
强 酸 |
强 碱 |
弱 酸 |
弱 碱 |
|
稀释10倍 |
增1 |
减1 |
增大值〈1 |
减小值〈1 |
|
稀释100倍 |
增2 |
减2 |
增大值〈2 |
减小值〈2 |
|
无限稀释 |
≈ 7(<7) |
≈7(>7) |
≈ 7(<7) |
≈ 7(>7) |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com