
3、实验中怎样选用温度计及读数时应注意哪些事项?
宜用有0.1分刻度的温度计,量程100℃,中和前酸和碱溶液的温度要相同,且都为室温,且测量时应尽可能读准,并估读到小数点后第二位。温度计的水银球部分要完全浸没在溶液中,而且要稳定一段时间后再读数,以提高所测温度的精度。(注:更精确的中和热实验,需要精确度 0.002℃。普通温度计不能达到此精确度,需用贝克曼温度计进行测量)。
2、实验中对盐酸、NaOH溶液浓度有何要求?
盐酸和NaOH溶液浓度的配制须准确,且NaOH溶液的浓度须稍大于盐酸的浓度。为使测得的中和热更准确,所用盐酸和NaOH溶液的浓度宜小不宜大,如果浓度偏大,则溶液中阴、阳离子间的相互牵制作用就大,表观电离度就会减小,这样酸碱中和时产生的热量势必要用去一部分来补偿未电离分子的离解热,造成较大误差(偏低)。
NaOH溶液必须现配,往往由于吸收空气中二氧化碳而导致浓度不准,影响实验结果。还要注意新配制的NaOH溶液要充分冷却至室温后才能使用。
1、是否所有酸与碱的中和热都是相同的?
在稀溶液中,强酸和强碱完全电离,所以它们的反应就是H+与OH-结合成H2O的反应,每生成lmol水放出的热量(中和热)是相同的,均为 57.3 kJ/mol。
但弱酸、弱碱在水溶液中不能完全电离,存在着电离平衡。弱酸或弱碱参与中和反应的同时,伴随着电离,电离过程要吸收热量,此热量就要由H+与OH-结合成水分子放出的热量来抵偿,所以总的来说中和热小于 57.3 kJ/mol。
3、作为节流的重要举措是科学控制燃烧反应,提高能源利用率,充分燃烧的条件有哪
些?
典例剖析
[例1]下列说法正确的是
A. 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热
B. 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热
C. 燃烧热或中和热是反应热的种类之一
D. 在稀溶液中,1molCH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ
解析:本题旨在考查对燃烧热、中和热的定义的理解,特别是两概念中应注意的问题,故不难确定答案为C。
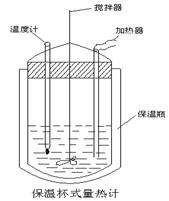
[例2]50 mL 0.50 mol/L盐酸与50 mL 0.55 mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:

(1)从实验装置上看,图中尚缺少的一种玻璃用品是___________________________。
(2)烧杯间填满碎纸条的作用是_____________________________________________。
(3)大烧杯上如不盖硬纸板,求得的中和热数值__________________(填“偏大”“偏
小”“无影响”)。
(4)实验中改用60 mL 0.50 mol/L盐酸跟50 mL 0.55 mol/L NaOH溶液进行反应,与上述实验相比,所放出的热量_________(填“相等”“不相等”),所求中和热_________(填“相等”“不
相等”),简述理由_____________________________________________。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值会______;用50 mL 0.50 mol/L NaOH溶液进行上述实验,测得的中和热的数值会__________________。(均填“偏大”“偏小”“无影响”)
解析:本实验成败的关键是准确测量反应后的温度.因此所用装置必须保温、绝热且可使体系温度尽快达到一致,故缺少的仪器应为环形玻璃搅拌棒.(2)碎纸条的作用为减少实验过程中的能量损失.(3)不盖硬纸板会损失部分热量故所测结果偏低.(4)由中和热概念可知,中和热只与生成水的量有关而与过量的酸碱无关,但液体体积增大温差减小,不便测
量.(5)由于弱酸弱碱的中和热等于H+与OH-生成H2O时的反应热加上其电离时吸热.
答案: (1)环形玻璃搅拌棒 (2)减少实验过程中的热量损失 (3)偏小 (4)不等 相等 因为中和热是指酸跟碱发生中和反应生成1 mol H2O所放出的能量,与酸碱的用量无关 (5)偏小 偏小。
[练习]中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,量热器要尽量做到绝热;在量热的过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
(1)中学化学实验中的中和热的测定所需的玻璃仪器有:____________________,在大小烧杯之间填满碎泡沫(或纸条)其作用是____________________。结合日常生活的实际该实验改在___________中进行效果会更好。
(2)该实验常用0.50 mol·L-1 HCl和0.55 mol·L-1的NaOH溶液各50mL。NaOH的浓度大于HCl的浓度作用是___________。当室温低于10℃时进行,对实验结果会造成较大的误差其原因是___________。
(3)若上述HCl、NaOH溶液的密度都近似为1 g/cm3,中和后生成的溶液的比热容C=4.18 J/(g·℃),则该中和反应放出热量为____________________kJ(填表达式),ΔH=___________ kJ/mol(填表达式)。
(4)若1.00 L 1.00 mol·L-1 H2SO4溶液与2.00 L 1.00 mol·L-1 NaOH溶液完全反应,放出114.6 kJ的热量,该反应的中和热为___________,表示其中和热的热化学方程式为_______________________________________。
答案:(1)大烧杯、小烧杯、温度计、量筒 保温、隔热、减少实验过程中热量的损失 保温杯
(2)保证盐酸完全被中和 散热太快
(3)0.418(t2-t1) -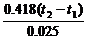
(4)57.3
kJ/mol 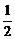 H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)=== Na2SO4(aq)+H2O(l);ΔH=57.3 kJ/mol
Na2SO4(aq)+H2O(l);ΔH=57.3 kJ/mol
[例3]在量热计中(见下图)。将100 cm3、0.500 mol·L-1CH3COOH溶液与100 cm3、0.500 mol·L-1 NaOH溶液混合,温度从298.16 K升高到300.71 K。已知量热计的热容常数(量热计各部件每升高1 K所需的热量)是150.5 J·K-1,0.250 mol·L-1CH3COONa溶液比热容为4.03 J·g-1·K-1,溶液的密度为0.963 g·cm-3。
(1)试求CH3COOH的中和热(中和反应生成1 mol水时放出的热量)。
(2)CH3COOH中和热的文献值为56.1 kJ·mol-1,你认为(1)中测得的实验值偏差可能是什么原因造成的?
(3)你认为CH3COOH的中和热与HCl的中和热相比,哪个大?为什么?
(4)向l L0.5 mol/L的NaOH溶液中加入下列物质:①稀醋酸;②浓H2S04;③稀HN03,恰
好完全反应时的热效应△H1,△H2,△H3的关系正确的是
A.△Hl>△H2>△H3 B.△H1 < △H 3<△H2 C.△H 3>△H 2>△H1 D.△H 1>△H3>△H2
解析:
(1)由中和热计算公式: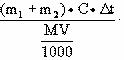 ,代如解得47.3 kJ/mol
,代如解得47.3 kJ/mol
(2)保温效果差或测温不准(4)因浓硫酸溶于水需要放热,所以②最大,应选B。
答案:(1)47.3 kJ/mol (2)实验值比文献值小;保温效果差或测温不准。(3)盐酸大,因CH3COOH电离中要吸热。
[例4](2004年广东高考化学试题)已知葡萄糖的燃烧热是2804KJ•mol-1,当它氧化生
成1g水时放出的热量是( )
A.26.0kJ B.51.9kJ C.155.8kJ D.467.3kJ
解析:根据葡萄糖燃烧的热化学方程式C6H12O6(g)+6O2(g)==6CO2(g)+6H2O(l);△H=-2804
KJ•mol-1,可知:生成6mol×18g•mol-1=108g水时放热2804KJ,则生成1g水时放热为(1g×2804KJ)/108g=26.0kJ 。故答案为A项。
疑难点拨-----解释中和热测定实验中几个为什么?
2、我国现有能源主体是: ,它们的特点是: 。本着可持续发展的观点,解决办法是: 。
1、能源的种类有: 哪些能源与化学反应有关?
3、燃烧热的定义: 。练习1:下列关于燃烧的说法,判断正误:
(1) 2C(s)+O2(g)=2CO(g) △H=120KJ/mol 燃烧热为: 120KJ/mol
(2)
H2(g)+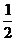 O2(g)=H2O(g)
△H=-483.6KJ/mol 燃烧热为: 483.6KJ/mol
O2(g)=H2O(g)
△H=-483.6KJ/mol 燃烧热为: 483.6KJ/mol
(3)
H2(g)+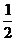 O2(g)=H2O(l) △H=-571.6KJ/mol 燃烧热为: 571.6KJ/mol
O2(g)=H2O(l) △H=-571.6KJ/mol 燃烧热为: 571.6KJ/mol
(4) CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-802KJ/mol 燃烧热为:802KJ/mol
思考2:对燃烧热的理解:
(1) ;
(2) ;
(3) ;
(4) 。
练习:书写1mol甲烷和1mol H2、1molCO、1mol酒精燃烧的热化学方程式:
思考3:从以下几个角度对上述的几种燃料进行比较:
★从单位物质的量燃烧热值的角度考虑:选用 较好。
★从环境污染(清洁能源)的角度考虑:选用 较好。
★从使用安全的角度考虑:家庭燃烧不建议用 。
★从成本角度考,建议选用 。
综合上述:你选择 作为家庭的主要燃料。
思考4:仿照中和热测定装置,设计测定燃烧热的装置,并画出相关图形?
思考5: 三大化石燃料有 ,作为燃料的优缺点
。其中 是较清洁的能源。
交流思考:(1)比较H2、CH4谁的热值高?(2)比较CH4和C2H5OH谁更环保?(3)为什么我国使用乙醇汽油作为汽油的代用品?
2、中和热的定义: 。
思考1:对中和热的理解:
(1) ; (2) ;(3) ;(4) 。
1、反应热的分类: 。
26.把一小块金属钠投入100 mL 0.15 mol/LCuCl2溶液中,收集到产生的气体的体积为1.456L(标准状况下),此时溶液体积仍然为100 mL 。计算
(1)加入金属钠的质量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com