
2、氯碱工业:氯碱工业所得的NaOH、Cl 2 、H2 都是重要的化工生产原料,进一步加工可得多种化工产品,涉及多种化工行业,如:有机合成、医药、农药、造纸、纺织等,与人们的生活息息相关。
[练习]1.关于工业生产的下列叙述,不正确的是( A )。
A.将氢气和氯气混合后光照,使其反应生成氯化氢,再用水吸收得盐酸
B.用硝酸镁作吸水剂,将稀硝酸蒸馏,浓缩制得95%以上的浓硝酸
C.以石灰石、纯碱、石英为原料,在玻璃窑中加强热制取普通玻璃
D.工业上采用电解熔融氯化镁的方法制取金属镁
2.怎样除去饱和食盐水中 Fe 3+ 、Mg 2+ 、Ca 2+ 、SO42-等杂质,(方法 、药品及反应方程式)。
答案:(1)先加BaCl2 溶液足量。 Ba 2+ + SO4 2- = BaSO4 ↓再加Na2CO3 溶液足量。Ba 2+ + CO3 2- = BaCO3↓ Ca 2+ + CO3 2- = CaCO3↓ Mg 2+ + CO3 2- = MgCO3↓再加NaOH 溶液足量。Mg 2+ +2 OH- = Mg(OH)2↓(2)过滤。(3)加适量盐酸。CO3 2- +2 H+ = CO2↑+ H2O H+ + OH- = H2O。
1、电解饱和食盐水:用一根碳棒作阳极,一根铁棒作阴极,电解饱和食盐水。溶液中存在的离子有_________。根据放电的先后顺序,阳极电极反应式为______________。阴极电极反应式为_______________。总反应式为:________________。电解前向溶液中滴加酚酞,现象_____________,随着电解反应的进行,溶液颜色由_______________,两极极板上都有_______________产生,如何检验气体的种类?
[练习]1.右图是世界上比较先进的电解制碱技术离子交换膜法电解原理示意图。写出各进出口的物质(1) (2) (3) (4) (5) (6) 。
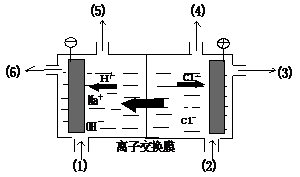
答案: (1) H2O(含少NaOH) (2) 精制饱和NaCl溶液 (3) 淡盐水 (4) Cl2 (5) H2 (6) NaOH溶液。
3. 关于“电解氯化铜溶液的PH值变化”问题,化学界
关于“电解氯化铜溶液的PH值变化”问题,化学界
有两种不同的观点:
观点一:“理论派”认为电解氯化铜溶液后溶液的PH值升高。
观点二:“实验派”经过反复、多次、精确的实验测定,
证明电解氯化铜溶液时PH值的变化如图所示曲线关系。请回答下列问题:
(1)电解前氯化铜溶液的pH处于A点位置的原因是:(用离子方程式说明)
。
(2)“理论派”所持观点的理论依据是: 。
(3)“实验派”的结论是: ,他们所述“精确的实验”是通过 确定的。
(4)你持何种观点,你所持观点的理由是: (从化学原理加以说明)。
答案:(1)Cu2+ + 2H2O  Cu(OH)2 +2 H+
Cu(OH)2 +2 H+
(2)电解时,溶质CuCl2减少,溶液浓度减少,导致PH值升高。
(3)pH值先降低,然后趋于稳定、PH值。
(4)“实验派”观点正确。电解产生的Cl2溶于水并与水反应生成两种酸,会使PH值降低,Cl2饱和后,pH值不再变化。
2.在外界提供相同电量的条件,Cu2+或Ag+分别按Cu2++2e→Cu或Ag++e→Ag在电极上放电,若析出铜的质量为1.92g,则析出银的质量为( B )。
A.1.62g B.6.48g C.3.24g D.12.96g
3、电镀原理
⑴当镀层金属作___极,含有镀层金属离子的电解质为电解液,把待镀金属制品浸入电镀液为____极时的电解即为_________。电镀时,由于两极得失电子相同,所以理论上电解液的浓度保持_________。
⑵电镀过程的特点:①牺牲阳极;②电镀液的浓度(严格说是镀层金属离子的浓度)保持不变;③在电镀的条件下,水电离产生的H+、OH-一般不放电。
如:电镀铜
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的过程。
在铁制品上镀铜:阳极--铜 阴极--铁制品 电镀液--CuSO4溶液
阴极:Cu2++2e-=Cu 阳极:Cu-2e-=Cu2+
电镀材料的选择:阴极--镀件 阳极--镀层金属 电镀液--含有镀层金属离子的溶液
思考:为什么很多器件是镀铜的,镀层被破坏,结果会怎样?
[练习] 1.氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是: H2 + 2 NiO(OH)2  2Ni(OH)2
根据此反应式,判断下列叙述正确的是( CD )。
2Ni(OH)2
根据此反应式,判断下列叙述正确的是( CD )。
A.电池放电时,电池负极周围溶液的OHˉ不断增大 B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原 D电池放电时,氢气是负极
2、电解池放电规律
⑴ 电解通电时,电子从电源的_____极沿导线流入电解池的_____极,在阴极区氧化性强的微粒先得电子,被_________。同时,电子又从电解池的________流出,沿导线流回电源的正极,即在阳极区还原性强的微粒(包括极板)先_______电子被_______。
⑵ 当极板材料(阳极)为 Pt 或C时,还原性非常弱,此条件不被氧化称为______电极。当极板材料(阳极)为Cu等金属(除了Pt和C),还原性强,易_______电子,易被氧化称为_______电极。
阴离子放电顺序:S2- > I- > Br- >Cl- > OH- > 含氧酸根> F-
阳离子放电顺序:Ag+ > Hg 2+> Fe 3+> Cu 2+ >H+> Pb 2+ >Sn 2+ >Fe 2+ >Zn 2+>Al 3+ >Mg 2+>Na+ >Ca 2+ >K+
3.A、B、C是三种金属,根据下列①、②两个实验,确定它们的还原性强弱顺序为( D )。
① 当A与B浸在稀硫酸中用导线相连,A上有气泡逸出,B逐渐溶解。② 电解物质的量浓度相同的A、C盐溶液时,阴极上先析出C(使用惰性电极)。
A.A>B>C B.B>C>A C. C>A>B D.B>A>C
2.100mL浓度为2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( B )。
A.加入适量的6mol/L的盐酸 B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
1、电解池组成:使电流通过电解质溶液,而在____________的过程叫电解。电离是电解的前提。电解质的导电过程即是被___过程。电解池由_____ _____ ______组成,其中与外电源的正极相连的极板叫____极,与外电源的负极相连的极板叫_____极。
[练习]1.下列说法或实验现象的描述不正确的是( B )。
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速度加快
D.与电源负极相连的是电解槽的阴极
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com