
1、加氧时,就在反应物中加H2O或OH-
a、在中性或碱性溶液中加OH-(2OH -  H2O+O2-)
H2O+O2-)
如钮扣电池以KOH为电解质溶液,其总反应式:Zn+Ag2O==2Ag+ZnO,根据加氧原则,负极反应式:Zn-2e-+2OH--== ZnO+H2O
b、在酸性溶液中加H2O(H2O 2H+ +O2-)
2H+ +O2-)
如铅蓄电池以硫酸为电解质溶液,其充电时,总反应式为:2PbSO4+2H2O==Pb+PbO2
+2H2SO4,其阳极反应式:PbSO4+2H2O-2e-=PbO2+ SO42---+ 4H+
5、加氧失氧原则
4、是否共存原则
电极反应式的书写必须考虑介质环境,物质得失电子后在不同的介质环境中所存在的形式不同。
例4、已知原电池总反应式为CH4+2O2===CO2+2H2O,(1)电解质溶液为KOH时,(2)电解质溶液为H2SO4时,分别写出该原电池的电极反应式。
解析:根据原电池总反应式可知,在反应中CH4被氧化,O2被还原,则CH4应在负极参加反应,O2应在正极参加反应。又根据是否共存原则,碱性溶液中CO2不可能存在,也不可能有H+参加反应,故负极反应式:CH4-8e-+10H+ CO32-+ 7H2O,正极反应式:O2+2H2O+4e-
CO32-+ 7H2O,正极反应式:O2+2H2O+4e- 4OH-。若电解质溶液换成酸性溶液,根据是否共存原则,不可能有OH-参加或生成,负极反应式:CH4-8e-+2H2O= CO2+8H+,正极反应式:O2+4e--+ 4H+
4OH-。若电解质溶液换成酸性溶液,根据是否共存原则,不可能有OH-参加或生成,负极反应式:CH4-8e-+2H2O= CO2+8H+,正极反应式:O2+4e--+ 4H+ 2H2O。
2H2O。
3、加和性原则
根据得失电子守恒,总反应式应为两极反应式之和,若已知一个电极反应式,可用总式减去已知的电极反应式,得另一电极反应式;反之,如果已知两个电极反应式,则它们之和就是总反应式。
例3、熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气体为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电极反应式:
阳极反应式:2CO+2CO32-- 4CO2+4e--
4CO2+4e--
阴极反应式:_______________________,总反应式:________________________。
解析:在解题时,习惯上总是按题号顺序从前到后依次进行解答,但此题会遇到很大的困难,这是不妨打破常规,进行逆向思维。先写出难度较小的总反应式,再写出阴极反应式。由题意可知阳极气和阴极气反应生成CO2,而CO2又不与Li2CO3和Na2CO3的熔融盐混合物反应,所以总反应式为2CO+O2=== 2CO2,同时又知阳极反应式,根据加和性原则可得阴极反应式:
2CO+O2=== 2CO2
 (2CO+2CO32--
(2CO+2CO32-- 4CO2+4e-)
4CO2+4e-)
O2+4e-+2CO2 2CO32-
2CO32-
2、与电解质溶液反应原则
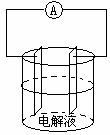 如果以较活泼金属(金属活动性顺序表Pt 以前)作原电池的电极材料,一般以能自发的与电解质溶液起反应的电极材料作负极,如Mg、Al与NaOH溶液形成原电池;Fe、Cu与浓硝酸形成原电池。都是相对不活泼金属作负极。
如果以较活泼金属(金属活动性顺序表Pt 以前)作原电池的电极材料,一般以能自发的与电解质溶液起反应的电极材料作负极,如Mg、Al与NaOH溶液形成原电池;Fe、Cu与浓硝酸形成原电池。都是相对不活泼金属作负极。
例2、如图所示,Mg、Al用导线连接后分别浸入不同的电解
质溶液中,均可形成原电池,请分别写出电解质溶液为(1)稀硫酸,(2)浓氢氧化钠溶液时的电极反应式。
解析:(1)电解质溶液为稀硫酸时,Mg、Al都能与稀硫酸反应,但Mg比Al活泼,所以Mg作负极,Al作正极,故电极反应式为:负极:Mg-2e- Mg2+,正极:2H++2e-
Mg2+,正极:2H++2e- H2↑。
H2↑。
(2)电解质溶液换为NaOH溶液时,Mg不能与NaOH溶液自发的进行反应,而Al是两性金属,能与NaOH溶液起反应,所以该原电池装置中Al作负极,Mg作正极,再结合是否共存原则,相应的电极反应式:负极:Al+4OH--3e- AlO2-+2H2O,正极:2H2O+2e--
AlO2-+2H2O,正极:2H2O+2e-- H2↑+2OH-。
H2↑+2OH-。
1、优先放电原理 电解电解质水溶液时,阳极放电顺序为:活泼金属阳极(Au、Pt 除外)>S2->I-> Br->Cl->OH-> 含氧酸根离子和F-。 即位于前边的还原性强的微粒优先失去电子。只要有水,含氧酸根离子和F-就不能失去电子。
阴极: Ag+>Hg+>Fe3+>Cu2+>Pb2+ > H+> Sn2+>Fe2+>Zn2+> H+ > Mg2+>Na+>Ca2+>K+。
即位于前边的氧化性强的微粒优先得到电子。只要有水,一般H后面的离子不能得到电子。
例1、1LK2SO4和CuSO4的混合液中,硫酸根离子的浓度为2mol/L,用石墨电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液中钾离子的浓度为
A 0.5mol/L B 1mol/L C 1.5mol/L D 2mol/L
解析:由题给信息可知n(SO42-)=2mol,又由放电顺序可知:
阴极反应:先发生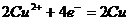 后发生
后发生
阳极反应: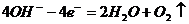
则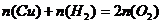
 则
则
又根据溶液中电荷守恒关系
C(K+)=2mol/L。答案:D
2、酸碱盐水溶液的电解规律
根据离子的放电顺序,若采用惰性电极电解酸碱盐的水溶液,则有下述四点规律.
(1)电解无氧酸或不活泼金属无氧酸盐的水溶液时,其实就是电解质发生分解反应.例如:

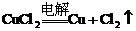
(2)电解某些强含氧酸、强碱、某些活泼金属含氧酸盐的水溶液时,实际上是电解水.例如,电解 等物质的水溶液,就属于此种情况。如:
等物质的水溶液,就属于此种情况。如:
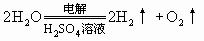
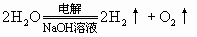

(3)电解活泼金属无氧酸盐的水溶液时,例如,电解NaCl、KBr、 等物质的水溶液,电解质和水都参加反应,阳极产物是非金属单质,阴极产物是
等物质的水溶液,电解质和水都参加反应,阳极产物是非金属单质,阴极产物是 同时生成碱(
同时生成碱(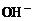 )。
)。
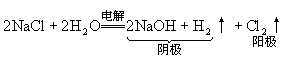
(4)电解某些不活泼金属含氧酸盐的水溶液时,例如,电解 等物质的水溶液,电解质和水都参加反应,阴极产物是不活泼金属单质,阳极产物是
等物质的水溶液,电解质和水都参加反应,阴极产物是不活泼金属单质,阳极产物是 同时生成酸(
同时生成酸( )。
)。

注意:上述规律的本质是离子在电极上的得失电子规律.
例题:采用惰性电极,电解符合下列各问题的电解质的水溶液,请从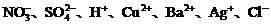 等离子中,选出适当的离子组合成符合要求的电解质.
等离子中,选出适当的离子组合成符合要求的电解质.
(1)两极分别放出 ,电解质的化学式是_______________,阴极反应式是_______________,阳极反应式是_______________.
,电解质的化学式是_______________,阴极反应式是_______________,阳极反应式是_______________.
(2)阴极析出金属,阳极析出 ,电解质的化学式是_______________;电解的化学方程式是______________________________.
,电解质的化学式是_______________;电解的化学方程式是______________________________.
(3)两极分别放出气体,且体积为1∶1,电解质的化学式是_______________,电解的化学方程式是______________________________.
分析与解答
(1)要求是酸碱盐水溶液的电解规律中第二点中的电解质;(2)是第四点中的电解质;(3)是第三点中的电解质或第一点中的电解质.
答案
(1)
1、离子的放电顺序
电解时,阴离子在阳极失去电子而被氧化,阳离子在阴极获得电子而被还原。我们把阴阳离子失去或获得电子的氧化还原过程叫做离子的放电。
(1)电解电解质水溶液时,阳极放电顺序为:活泼金属阳极(Au、Pt 除外)>S2->I-> Br->Cl->OH-> 含氧酸根离子和Fˉ。 即位于前边的还原性强的微粒优先失去电子。只要有水,含氧酸根离子和F-就不能失去电子。若阳极是活泼或较活泼金属时,一般是电极的金属失去电子,而不是电解液中阴离子放电。
(2)电解电解质水溶液时,阴极放电顺序为:Ag+>Hg+>Fe3+>Cu2+>Pb2+> H+> Sn2+>Fe2+>Zn2+> H+ > Mg2+>Na+>Ca2+>K+。
阳离子放电,其顺序大体可参照金属活动顺序来推断。位于金属活动顺序表后面的金属,其对应的阳离子越易得到电子: 即位于前边的氧化性强的微粒优先得到电子。只要有水,一般H后面的离子不能得到电子。
注意:
(1)活泼金属离子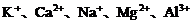 在溶液中不会得到电子.
在溶液中不会得到电子.
(2) 等不会失去电子.
等不会失去电子.
(3)当 或
或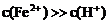 时,
时, 先得电子而
先得电子而 后得电子。
后得电子。
(4)石墨和金属铂是惰性电极,不会得失电子。
2、铜的电解精炼
粗铜作阳极,纯铜作阴极,用CuSO4溶液作电解液。
阴极:Cu2++2e-=Cu 阳极:Cu-2e-=Cu2+
比铜活泼的金属杂质--以阳离子形式留于溶液中
比铜不活泼的金属杂质--形成阳极泥
电解精炼铜过程中CuSO4溶液的浓度基本不变。
疑难点拨
2.用石灰石、食盐、焦炭、水为空气为原料制取漂白粉、聚氯乙烯、乙酸乙酯的有关化学方程式。
答案:制取漂白粉:
CaCO3 =CaO + CO2↑ 2 NaCl + 2 H2O =H2↑ + Cl2↑ 2NaOH CaO + H2O == Ca(OH) 2 Ca(OH)2(石灰乳)+2 Cl2 = Ca(ClO)2+CaCl2 +2 H2O
制聚氯乙烯:CaO + 3C == CaC2 + CO↑ H2
+ Cl2 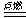 2HCl CaC2 + 2H2O
2HCl CaC2 + 2H2O HC≡CH↑ + Ca(OH) 2 HC≡CH
+ HCl
HC≡CH↑ + Ca(OH) 2 HC≡CH
+ HCl  HC=CHCl
HC=CHCl 
制取乙酸乙酯:HC≡CH
+ H2O  CH3CHO CH3CHO + H2
CH3CHO CH3CHO + H2 CH3CH2OH
CH3CH2OH
2CH3CHO + O2  2CH3COOH CH3COOH + CH3CH2OH
2CH3COOH CH3COOH + CH3CH2OH CH3COOCH2CH3
+ H2O
CH3COOCH2CH3
+ H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com