
3、同温同压下,同体积的任何气体的质量比等于摩尔质量之比,等于密度之比。即: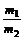 =
=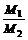 =
=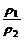 。
。
2、同温同体积下,气体的压强与物质的量成正比。对于一反应体系(包括密闭体系),气体总的物质的量之比等于压强比。即: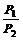 =
=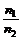 。
。
阿伏加德罗定律:同温同压下,同体积的气体具有同数的分子。
在非标准状况下,不能用气体摩尔体积22.4 L / mol进行计算,这时可利用阿氏定律及其有关关系来计算。
由这一定律可知:① 同温同压下,同体积的任何气体含有相同物质的量的分子;② 同温同压下任何混合气体的分子总数与相同状态下的各纯气体的分子数之和相同。并且还可推出气体反应定律:在有气体存在的化学方程式中,气体物质的化学计量数之比,既是分子数之比,物质的量之比,也是相同状态下气体体积比。
与此相关的还有以下几条规律应掌握:
1、同温同压下,气体的体积与物质的量成正比。对于一反应体系(包括密闭体系),气体总体积与总的物质的量成正比。即: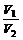 =
=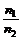 。
。
13.电解26.8%的食盐水1500g,若食盐的利用率为87.3%,求: (1)在27℃和1.11×105大气压下可制得H2多少升?(2)这些氢气和氯气全部化合成氯化氢,溶于水制成功31%的盐酸,其质量为多少g?(3)电解液中氢氧化钠的质量分数浓度为多少?
12.由于Fe (OH)2极易被氧化,所以实验室很难用亚铁盐溶液与烧碱反应制得白色纯净的Fe (OH)2沉淀,应用下图电解实验可以制得白色的纯净的Fe (OH)2沉淀。两电极材料分别为石墨和铁。

⑴ a电极材料应为____,电极反应式为________________。
⑵ 电解液C可以是__________。
A.纯净水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
⑶ d为苯,其作用是______________,在加入苯之前对C应作何简单处理_____________
⑷ 为了在较短时间内看到白色沉淀,可采取的措施是________。
A.改用稀硫酸作电解液 B.适当增大电源的电压。
C.适当减小两电极间距离 D.适当降低电解液的温度。
⑸ 若C中用Na2SO4溶液,当电解一段时间看到白色Fe (OH)2沉淀后,再反接电源电解,除了电极上看到气泡外,混合物中另一明显现象为_____________________。
11.氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下:
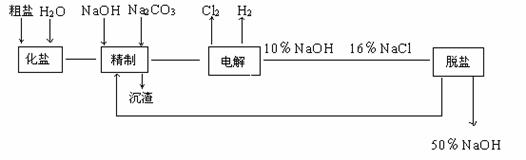
依照图示,完成下列填空:
⑴ 在电解过程中,与电源正极相联的电极上所发生反应的化学方程式为___________与电源负极相连的电极附近,溶液pH值__________(选填:不变,升高或下降)。
⑵ 工业食盐含Ca2+ 、Mg2+等杂质,精制过程发生反应的离子方程式为___________ 。
⑶如果粗盐中SO42- 含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是__________。
A.Ba (OH)2 B.Ba (NO3 )2 C.BaCl2
⑷ 为有效除去Ca2+ 、Mg2+ 、 SO42-,加入试剂的合理顺序为_____(选填A、B、C,多填扣分)。
A.先加NaOH,后加 Na2CO3,再加钡试剂。B.先加NaOH,后加钡试剂,再加Na2CO3。
C.先加钡试剂,后加NaOH,再加Na2CO3。
⑸ 脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过______冷却、_______(填写操作名称)除去NaCl。
⑹ 在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与 NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与 NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为___________________ 。
10.用惰性电极电解M (NO3 )x 的水溶液,当阴极上增重 a 克时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为( )。
A.22.4ax/b B.11.2 ax/b C.5.6 ax/b D.2.5 ax/b
9.甲、乙两个电解池均为 Pt 电极,且互相串联,甲池盛有AgNO3溶液,乙池中盛有一定量的某盐溶液,通电一段时间后,测得甲池中电极质量增加 2.16g,乙池中电极上析出 0.24g 金属,则乙池中溶质可能是( )。
A.CuSO4 B.MgSO4 C.Al (NO3)3 D.Na2SO4
8.溶液中含有两种溶液质-氯化钠和硫酸,他们的物质的量之比为3:1。用石墨做电极电解该溶液时,根据反应产物可明显分为三个阶段,则下列叙述不正确的是 ( )。
A.阴极只析出氢气 B.阳极先析出氯气后析出氧气
C.电解最后阶段为电解水 D.电解过程中溶液的PH不断增大,最后PH为7
7.按A图装置进行实验,若图B的X轴表示流入电极的电子的量,则Y轴不可能表示的情况是( )。
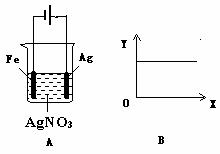
A.[Ag+] B.[NO3] C.溶液的PH D.银棒的质量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com