
3.实验室需用480mL0.1 mol/L的硫酸铜溶液,现选取500 mL容量瓶进行配制,以下操作正确的是
A.称取7.68g硫酸铜,加入500 mL水 B.称取12.0g胆矾配成500 mL溶液
C.称取8.0g硫酸铜,加入500 mL水 D.称取12.5g胆矾配成500 mL溶液
2.(2006全国理综Ⅱ·9)某氯化镁溶液的密度为1.18g/cm3,其中镁离子的质量分数为5.1%,300mL该溶液中Cl-离子的物质的量约等于
A 0.37mol B 0.63mol C 0.74mol D 1.5mol
1.(2006上海8)某非金属单质A和氧气发生化合反应生成B。B为气体,其体积是反应掉氧气体积的两倍(同温同压)。以下对B分子组成的推测一定正确的
A 有1个氧原子 B 有2个氧原子 C 有1个A原子 D 有2个A原子
① 同c、同V的溶液中所含溶质的物质的量相等。
② 从一溶液中取出任一体积的溶液,其溶质的物质的量浓度不变,但溶质的物质的量和质量都减少。
(1) 有关量纲式:c=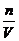 ;m=V×r×w ;m=c×V×M
;m=V×r×w ;m=c×V×M
(2) 用浓溶液A(用质量分数表示)配制稀溶液B(用物质的量浓度表示)求所需浓溶液的体积VA
cB × VB × M = wA × VA × r A
(mol / L) (L) (g / mol) % (mL) (g / cm3)
(3) 物质的量浓度与溶质的质量分数之间的换算
令V=1L=1000 mL,则得:c =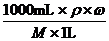
(4) 稀释规则:稀释前后溶质的质量和物质的量不变。
m浓×w 浓 = m稀×w 稀
V浓×r浓×w 浓 = V稀×r稀×w 稀
c浓×V浓 = c稀×V稀
(5) 混合规则:混合前后溶质的质量不变。
m1×w1% +m2×w2% = m3×w3% ,式中,m1+m2 = m3 (质量有加和性)
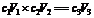 若告诉混合后溶液的密度,则有体积效应,即V1+V2 ¹ V3(体积没有加和性),混合后溶液的体积要根据混合溶液的密度来计算。
若告诉混合后溶液的密度,则有体积效应,即V1+V2 ¹ V3(体积没有加和性),混合后溶液的体积要根据混合溶液的密度来计算。
典例剖析
[例1]已知铁的相对原子质量是56,则1个铁原子的质量是__g。
解析:依题意,1molFe为56g,而1molFe约有6.02×1023个铁原子。则1个铁原子的质量为:
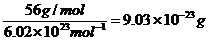
[例2]在24g碳原子中,所有碳原子的电子数为___个。
解析:本题解题思路是:m→n→N→电子数。
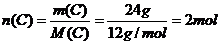
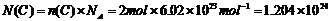
一个碳原子有6个电子,故总电子数为:
6×1.204×1024=7.224×1024个
[例3]2.3g金属钠与水反应后,所得的溶液中,要使每100个水分子中溶解有1个Na+,求所需水的质量。
解析:2.3g Na为0.1mol,产生的Na+也为0.1mol。
设与0.1molNa反应消耗水的物质的量为xmol,生成NaOH的物质的量为ymol。
2Na + 2H2O= 2NaOH +H2↑
46g 2mol 2mol
2.3g x y
列比例式解得:x=0.1mol,y=0.1mol。
生成0.1molNaOH在水中完全电离,故溶液中有0.1mol的Na+。
设与0.1mol Na+配比的水的物质的量为zmol。则有:
N(Na+)∶N(H2O)=n(Na+)∶n(H2O)
1∶100=0.1∶z, 解得:z=10mol。
所以,总共需H2O的物质的量为:
x+z=0.1mol+10mol=10.1mol。
m(H2O)=n(H2O) ×M(H2O)=10.1mol×18g/mol=181.8g。
延伸点拨:由本题求解过程可知,物质的量起到了微观与宏观的桥梁作用。
[例4]某硫酸钠溶液中含有3.01×1022个Na+,则该溶液中SO42-的物质的量是___。
解析:n(Na+)=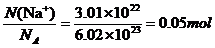 。
。
根据电离方程式:Na2SO4= 2Na++SO42- 有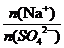 =
=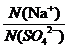 ,
,
以n(SO42-)=n(Na+)×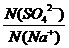 =0.05mol×
=0.05mol×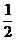 =0.025mol。
=0.025mol。
[例5]4℃时某一滴管滴出30滴水,体积为amL,则每滴水中所含的水分子数为
A.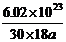 B.
B.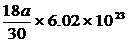
C.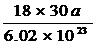 D.
D.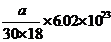
解析:30滴水的体积为a mL,即ag,物质的量为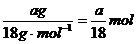 ,所含的水分
,所含的水分
子数为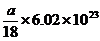 个,因此D正确。
个,因此D正确。
[例6]下列关于物质的量的叙述中,错误的是
A.1 mol任何物质都含有6.02×1023个分子
B.0.012 kg 12C中含有约6.02×1023个碳原子
C.1 mol水中含有2 mol氢和1 mol氧
D.1 mol Ne含有6.02×1024个电子
解析:因为有些物质是由分子组成(例如水、硫酸等),有些物质是由离子组成(例如NaCl、Ca(OH)2等),还有些物质是由原子直接构成的(例如金刚石等),所以A的叙述是错误的。碳是由原子构成的,根据规定,0.012 kg 12C中所含的碳原子数即为阿伏加德罗常数,其近似值为6.02×1023 mol-1,所以B的叙述是对的。根据规定,“使用摩尔表示物质的量时,应该用化学式指明粒子的种类,而不使用该粒子的中文名称”。C中表示水的组成时,却用名称表示,所以也是不正确的。氖原子核外有10个电子,则1 mol Ne也应含有10×6.02×1023个电子,所以D的叙述是正确的。答案:AC。
[例7] 由CO2、H2和CO组成的混合气在同温同压下与氮气的密度相同。 则该混合气体中CO2、H2和CO的体积比为
A.29:8:13 B.22:1:14 C.13:8:29 D.26:16:57
解析:由于CO与N2具有相同的分子质量,所以CO2、H2、CO混合气体的平均相对分质量仅由CO2和H2来决定,CO的量可以任意。由十字交叉法:
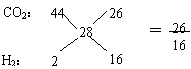
即C、D都符合,故选C、D。
[例8](2003年全国)A、B、C是短周期ⅠA和ⅡA族元素的碳酸盐,它们的质量分别为 mA、mB、mC,与足量盐酸完全反应,消耗盐酸的物质的量分别为nA(HCl)、nB(HCl)、nC(HCl)。
已知:mA=mB+mC,nA(HCl)=nB(HCl)+ nC(HCl)。请填空:
(1)写出短周期ⅠA和ⅡA族元素形成的所有碳酸盐的名称:
(2)若以MA、MB和MC分别表示A、B、C的相对分子质量,试写出MA、MB和MC三者的相互关系式 。
(3)A的正确选择有 种,其化学式为: 。
(4)若A和B为ⅡA族元素的碳酸盐,C为ⅠA族元素的碳酸盐,则A、B、C的化学式依次是 ,mB︰mC=1︰ 。(保留2位小数)
解析:(1)IA、IIA族短周期元素有Li、Na、Be、Mg故碳酸盐名称为碳酸锂,碳酸钠,碳酸铍,碳酸镁。
(2)nA(HCl)=2n(A) nB(HCl)=2n(B) nC(HCl)=2n(C)
故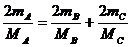 即
即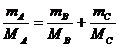 即
即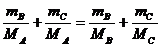
MA ≠MB ≠MC
∴若MA<MB则MA>MC此时MC<MA<MB ;若MA>MB则MA<MC此时MB<MA<MC
(3)M(Li2CO3)=74g·moL-1,M(BeCO3)=69g·moL-1
M(Na2CO3)=106g·moL-1,M(MgCO3)=84g·moL-1
故A的选择有2种,Li2CO3 和MgCO3。
(4)A为IIA族的碳酸盐,则A为MgCO3,B为IIA族,则B为BeCO3,此时C只能为Na2CO3。
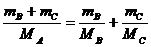 整理,得
整理,得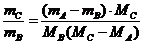 ,
,
代入得 mB:mC=1:1.05
答案:(1)碳酸锂,碳酸钠,碳酸铍,碳酸镁(2) 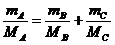 或MB<MA<MC;MC<MA<MB(3)2种 Li2CO3 MgCO3(4)MgCO3,BeCO3,Na2CO3 1.05
或MB<MA<MC;MC<MA<MB(3)2种 Li2CO3 MgCO3(4)MgCO3,BeCO3,Na2CO3 1.05
[例9]在25℃101kPa下,将15L02通入10LCO和H2的混合气体中,使其完全燃烧,干燥后恢复至原来的温度和压强。
(1)若剩余气体的体积为15L,则原CO和H2的混合气中,V(CO)=_____L,V(H2)=_____L。
(2)若剩余气体体积为aL,则原CO和H2的混合气中,V(CO):V(H2)=__________。
(3)若剩余气体的体积为aL,则a的取值范围是__________。
解析:由反应原理2CO+O2=2CO2 ①
在同温、同压下CO和H2的混合气体
2H2+O2=2H2O ②
完全燃烧耗O2的体积为混合气体的1/2,即[V(CO)+V(H2)]=2V(O2)
(1)当V(CO)+V(H2)=10L时,要使其完全燃烧,必须有V(O2)≥5L。已知V(O2) =15L,则O2过量10L。又因反应后剩余气体的体积是15L,在25℃、101KPa条件下,水的状态为液体,则剩余气体为CO2和O2的混合气。故反应生成的二氧化碳的体积V(CO2)=5L,则由反应原理①得:V(CO)=5L,V(H2)=10-V(CO) =5L。
(2)由题(1)可以推理得:V(CO2)=(a-10)L;依反应原理①有V(CO)=(a-10)L;V(H2)=10L-(a-10)L =(20-a)L。则V(CO) :V(H2) =(a-10) : (20-a)。
(3)由题(2)结论有:(a-10):(20-a)>0;即(a-10)>0,20-a>0,所以10 <a< 20。
[例10] 在一定温度下,某饱和氢氧化钠溶液体积为V mL,溶液密度为d g·cm-3,质量分数(质量百分比浓度)为w%,物质的量浓度为c mol·L-1,溶液中含氢氧化钠质量为m g。
(1)用w来表示该温度下氢氧化钠的溶解度(S)为 。
(2)用m、V表示溶液中溶质的物质的量浓度c为 。
(3)用w、d表示溶液中溶质的物质的量浓度c为 。
(4)用c、d表示溶液中溶质的质量分数为 。
解析:这是一道只给出抽象符号的有关溶解度、质量分数、物质的量浓度的相互换算的问题。解答本题的关键是:在准确把握溶解度、溶液中溶质质量分数、溶液中溶质物质的量浓度的基础上,从未知求问的概念出发,进行概念分析,抓好相关概念的相互联系,便可顺利完成这种用符号表示的相互换算。
答案:(1)S=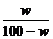 ×100 g
×100 g
(2)c=1000
mL·L-1×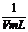 ×
×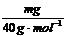 =
=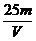 mol·L-1
mol·L-1
(3)c=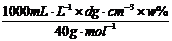 =0.25 dw mol·L-1
=0.25 dw mol·L-1
(4)w%=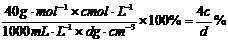
知能训练
3、、求混合气体(气体间不发生反应)的平均摩尔质量或平均相对分子质量
(1) 物质的量定义法: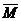 =
=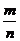
(2) 密度法: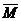 =
= ×22.4 mol / L
×22.4 mol / L
(3) 平均量法:混合气体可看成一种气体,不过平均分子量应按下式计算:
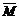 =M1×n1%+M2×n2%+……=M1×V1%+M2×V2%+……
=M1×n1%+M2×n2%+……=M1×V1%+M2×V2%+……
2、、求气态有机物的摩尔质量或相对分子质量
(1) 物质的量定义法:M=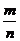
(2) 密度法:M=r×22.4 mol / L
(3) 质量体积法:M=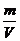 ×22.4 mol / L
×22.4 mol / L
(4) 相对密度法:Mr1=D×Mr2;Mr =29 D空 ,Mr =2 。(微观法)
。(微观法)
1、关于气体的相对密度。
气体的相对密度是指两种气体的密度比。
D=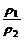 =
=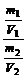 =
= 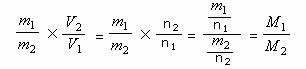
故相对密度可以看作是气体的相对分子质量之比。因此,相对密度单位为1,是一个微观量。利用相对密度可求气态物质的相对分子质量。
Mr1=D×Mr2
若以空气作标准,则为:Mr =29 D空 ,若是氢气作标准,则为:Mr =2 。
。
6、当温度相同,物质的量也相同时,气体的体积与压强成反比。即: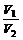 =
=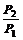 。
。
5、同温同体积时,等质量的任何气体的压强之比等于摩尔质量的反比。即: 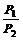 =
=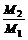 。
。
4、同温同压下,相同质量的任何气体的体积比等于摩尔质量之反比。即: 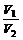 =
=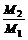 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com