
7.痕检是公安机关提取犯罪嫌疑人指纹的一种重要方法,AgN03显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,指纹就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是
A.①AgN03 ②NaBr ③AgBr B.①AgN03 ②NaCl ③AgCl
C.①AgCl ②AgN03 ③NaCI D.①AgN03 ⑧NaI ③Agl
二、根据要求完成方程式
8、写出下列反应的离子方程式
(1)硫化氢通入硫酸铜溶液
(2)硫化亚铁与稀硫酸
(3)锌和盐酸
(4)硫酸和氧化铜
(5)氯气通入氢氧化钠溶液
(6)铜片放入硝酸银溶液
9、写出可实现下列变化的化学方程式
(1)CO32-+2H+=H2O+CO2↑
(2)Br2+2I-=I2+2Br-
(3)Cu2++S2-=CuS↓
(4)Cu2++2OH-=Cu(OH)2↓
三、填空题
10.除去下列物质中的杂质(括号内为杂质)
|
物质 |
选用试剂 |
离子方程式 |
|
Na2SO4(NaHSO4) |
|
|
|
FeSO4(FeS) |
|
|
|
NaCl(MgSO4) |
|
|
|
KCl(K2CO3) |
|
|
|
BaSO4(BaCO3) |
|
|
6.在医院实施外科手术时,常用HgCl2稀溶液作为手术刀的消毒剂,已知HgCl2有如下性质:①HgCl2晶体熔点较低;②HgCl2在熔融状态下不能导电; ③HgCl2在水溶液中可发生微弱电离。下列关于HgCl2的叙述正确的是
A.HgCl2属于共价化合物 B.HgCl2属于离子化合物
C.HgCl2属于非电解质 D.HgCl2属于强电解质
5.美国等国家发射的航天器将我国研制的磁谱仪带入太空,其目的是探测反物质,反物质的主要恃征是电子带正电荷,质子带负电荷。以下表示反物质酸碱中和反应的通式是
A.H-+OH+=H20 B.H++OH-=H20
C.H+OH-=H20 D.H++OH+=H20
1.加入适量的浓H2SO4,使下列离子浓度减小的是
A.CO32- B.Cl- C.Na+ D.OH-
2.在Cl2+S2-=2Cl-+S↓离子反应中,S2-代表的硫化物可以是
A.氢硫酸 B.硫化钠 C.硫化亚铁 D.硫化铵
3.(2006江苏)下列反应的离子方程式错误的是
A.铁跟稀硫酸反应Fe+2H+=Fe2++H2↑
B.铜跟浓硝酸反应Cu+2N03-+4H+=Cu2++2N02↑+2H2O
C.碳酸钙跟稀盐酸反应C032-+2H+=CO2↑+H2O
D.铁跟氯化铁溶液反应Fe+2Fe3+=3Fe2+
4.在酸性溶液中能大量共存的无色离子组是
A.K+、Mg2+、Cl-、MnO4- B.Na+、Cu2+、CO32-、NO3-
C.K+、Na+、SO32-、Cl- D.Na+、Mg2+、Cl-、SO42-
2.附加隐含条件的应用规律:
(1)溶液无色透明时,则溶液中肯定没有有色离子.常见的有色离子是Cu2+、Fe3+、Fe2+、
MnO4-等.
(2)强碱性溶液中肯定不存在与OH-起反应的离子.
(3)强酸性溶液中肯定不存在与H+起反应的离子.
典型剖析
[例1] 下列物质中,属于强电解质的是( ),属于弱电解质的是( ),属于非电解质的是( )。
A. 碘化钾 B. 乙醇 C. 氨气 D. 蔗糖 E. 氢硫酸
F. 硫酸氢钠 G. 氨水 H. 液氧 I. 氢氧化钠溶液
解析:抓住电解质、非电解质概念区别。化合物--不导电(即不电离),是非电解质,故应选B、C、D为非电解质。
强电解质、弱电解质本质区别:电解质--全部电离(即强酸、强碱、盐)为强电解质,故应选A、F,而E、G为弱电解质。
此题易出错为在强电解质中选氢氧化钠溶液,应注意,此为混合物,不应是电解质范围。
注:对于酸和碱在电解质上的选择有特殊规定,一般称为某酸都视为电解质(包括溶液,因有些酸只存在于溶液中,如硫酸),对于某碱(除NH3·H2O只存在于氨水中外)一般只有固态时为电解质,其溶液均视为混合物。答案:A、F;E、G;B、C、D。
[例2]下列离子方程式正确的是( ) A.碳酸氢钙溶液与盐酸混合 HCO3-+H+=H2O+CO2↑ B.氢氧化铜中加入盐酸 H++OH-=H2O C.氯化铁溶液中加入铁钉 Fe3++Fe=2Fe2+ D.铁与盐酸反应 2Fe+6H+=2Fe3++3H2↑
解析:B选项中Cu(OH)2难溶于水,要用化学式表示,不能写成离子形式。正确的应写成:Cu(OH)2+2H+=Cu2++2H2O。C选项中氧化剂与还原剂之间转移的电子数不相等(即左、右两边电荷不守恒),正确的应写成:2Fe3++Fe=3Fe2+。D选项不符合实验事实,生成物写错,Fe与HCl反应生成FeCl2,而不是FeCl3。正确的应写成:Fe+2H+=Fe2++H2↑。答案为:A
[例3]在强酸性溶液中能大量共存,并且溶液为无色透明的离子组是( ) A.NH4+、Al3+、SO42-、NO3- B.K+、Na+、S2-、Cl- C.K+、NH4+、MnO4-、SO42- D.Na+、K+、NO3-、HCO3- 解析:在强酸性条件下,要考虑这些离子与H+能否共存。溶液为“无色透明”要考虑各离子的颜色。S2-、HCO3-均与H+不能共存S2-+2H+=H2S↑,HCO3-+H+=H2O+CO2↑,而MnO4-在水溶液中呈紫色。答案为:A
[例4]用一种试剂除去下列各物质中的杂质(括号中的物质),写出所用试剂及离子方程式,并简述操作方法。
⑴ BaCl2(HCl)试剂_______________________________________;
离子方程式_______________________________________________________;
操作方法_________________________________________________________。
⑵ O2(CO2)试剂_______________________________________;
离子方程式_______________________________________________________;
操作方法_________________________________________________________,
⑶ Cu(Zn)试剂_______________________________________;
离子方程式_______________________________________________________;
操作方法_________________________________________________________。
解析:
(1)适量Ba(OH)2或BaCO3;H++OH-=H2O;调至中性。
(2)气体通过足量NaOH溶液; CO2+2OH-=CO32-+H2O;洗气。
(3)足量CuSO4溶液;Zn+Cu2+=Cu+Zn2+;过滤。
[例5]选择常用仪器,用较简便的方法证实氢氧化钡与硫酸的反应是离子反应.要求画出简单的实验装置图,并写出实验操作步骤.
解析:由于氢氧化钡和硫酸可发生如下离子反应:Ba2++2OH-+2 H++SO42-=BaSO4↓+2H2O,由此可知,当溶液混合时时,溶液中自由移动离子浓度发生了变化,根据溶液中自由移动的离子浓度的变化,可证明该反应是否是离子反应.因此,可设计溶液的导电性实验来证明是否发生离子反应。
答案 (1)按如图所示把装置连接好.
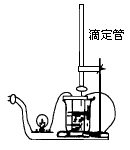
(2)将一定体积的氢氧化钡溶液或稀硫酸加入烧杯中,将稀硫酸或氢氧化钡溶液加入酸式或碱式滴定管中.
(3)接通直流电源,发现灯泡明亮.因为氢氧化钡或硫酸在溶液中电离出Ba2+、OH-或 H+、SO42-,因而溶液容易导电。
(4)将滴定管中的稀硫酸或氢氧化钡溶液逐滴加入烧杯中的溶液里,发现灯泡由明亮变暗,直至不亮.继续滴加稀硫酸或氢氧化钡溶液,灯泡由暗变亮.由灯泡的明暗变化可知溶液中离子的浓度发生了变化,从而证明氢氧化钡与硫酸的反应是离子反应。
知能训练
所谓几种离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存.
1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶
液中大量共存.
(1)生成难溶物或微溶物:如Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-和OH-、OH-与Cu2+等不
能大量共存.
(2)生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-、S2-、HSO3-、SO32-等不能大
量共存.
(3)生成难电离的物质:如H+与CO32-、S2-、SO32-、F-、ClO-等生成弱酸;OH-与NH4+、Cu2+
等生成弱碱;H+与OH-生成水,这些离子不能大量共存.
(4)发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+、SO32-等)不能大量共存.注意Fe2+与Fe3+可以共存;MnO4-与Cl-不能大量共存.
5、必须遵循定组成原理(即物质中阴、阳离子组成固定).
释例4:Ba(OH)2溶液和稀H2SO4混合:Ba+OH-+H++SO42-=BaSO4↓+H2O(错误),正确的是:Ba2++2OH-+SO42-+2H+=BaSO4↓+2H2O.
4、氧化还原反应还必须遵守得失电子守恒原理.应注意判断氧化剂和还原剂转移电子数是否配平.
3、必须遵守电荷平衡原理.
释例3:氯气通入FeCl2溶液中:Fe2++Cl2=Fe3++2Cl-(错误),正确的是:2Fe2++Cl2=2Fe3++2Cl-.
2、必须遵守质量守恒定律.
释例2:Cl2+I-=Cl-+I2(错误),正确的是:Cl2+2I-=2Cl-+I2.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com