
4、下列说法中正确的是
A.某反应低温条件下能自发进行,那么高温条件下也一定能自发进行
B.某反应高温条件下不能自发进行,那么低温条件下也不能自发进行
C.反应方向是由焓变和熵变共同决定的,与反应温度无关
D.温度有可能对反应的方向起决定性的作用
180.50 kJ·mol-1△S = 247.7J·mol-1·K-1 ,若不考虑温度对该反应焓变的影响,则下列说法中正确的是
A.在1000℃时,此反应能自发进行 B.在1000℃时,此反应不能自发进行
C.该反应能自发进行的最低温度约为730℃
D.该反应能自发进行的最高温度约为730K
3、闪电时空气中的N2和O2会发生反应:N2(g)+O2(g)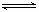 2NO2(g),已知该反应的△H =
2NO2(g),已知该反应的△H =
2、下列反应中熵减少的是
A.食盐晶体溶于水 B.氢气在氧气中燃烧生成液态水
C.碳酸氢铵分解 D.水蒸气冷凝为水
1. (2004年连云港模拟题)2003年10月15日,我国“神舟”五号载人飞船成功发射。航天飞船是用铝粉与高氯酸铵的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应:
2NH4ClO4 N2↑+4H2O+Cl2↑+2O2↑;ΔH<0。下列对该反应的叙述不正确的是
A.高氯酸铵的水溶液呈酸性 B.该反应属于分解反应、氧化还原反应、放热反应
C.该反应中反应物的总能量小于生成物的总能量
D.反应从能量变化上说,主要是化学能转变为热能和动能
2、如果反应为SiO2+2C=Si+2CO↑,则:△G°4=[(-137.3)×2+0]-(-805.0+2×0)=△H-T△S =530.4(kJ)>0
由于△H-T△S均为正值大于零,则这两个反应在标准状态都不能自发发生。那么在高温下能否进行?可以用△H-T△S进行进一步计算与研讨。 当反应为SiO2+C=Si+CO2↑时,
△ H°3=(-393.51+0)-(-859.4+0)=465.89(kJ)
△S°3=(213.64+18.7)-(41.86+5.69)=184.79(J·K-1)。
我们可以得到这样一个式子:△H-T△S=465.89-184.79×10-3 T 设△H-T△S <0 即465.89-184.79×10-3T< 0 。我们可以解出T>2521.18K,也就是说当温度升高到2521.18K时,该反应能发生。 当反应为SiO2+2C=Si+2CO↑时
△H°4=(-110.53×2+0)-(-859.4+2×0)=638.34(kJ)
△S°4=(197.91×2+18.7)-(41.86+2×5.69)=361.28(J·K-1)
△G°4=△H-T△S=638.34-361.28×10-3T
设△G°4<0即638.34-361.28×10-3T<0
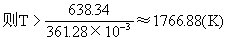
即当温度超过1766.88K时,反应按生成Si和CO方式进行。
经以上近似计算,在高温条件下,△G3、△G4可变为负值。也就是说,在高温条件下这两个反应都能进行。但生成Si和CO的反应比生成Si和CO2的反应易进行,因生成Si和CO的温度较生成Si和CO2低754.3K(2521.78-1766.88=754.3K)。所以将SiO2跟C的反应写SiO2+2C=Si+2CO更能合乎实际反应事实。用同样的方法验证ZnO跟C的反应其产物应是Zn和CO,多数同学往往错写成:2ZnO+C=CO2+2Zn。
知能训练
通过教材学习,我们知道反应的自发性不仅与焓变和熵变有关,而且还与温度条件有关。
化学反应的方向是焓变和熵变共同影响的结果,判断依据为△H-T△S,即依据△H-T△S的值的大小判断。△H-T△S又称自由能,符号△G,△G=△H-T△S,在等温等压下,自由能变化(△G)的正负决定着化学反应进行的方向和程度。而△G又与△H、△S及T密切相关。关系如下:

现在我们利用△H-T△S对中学化学中的两个问题探讨。 对于C还原CuO所发生的反应有下列两种可能情况: 1、如果反应为:2CuO+C=2Cu+CO2↑,直接根据各物质的△G计算,则: 则△G°1=(-394.4+2×0)-[2×(-127.2)+0]=- △H-T△S= -140.0(kJ)<0
2、如果反应为:CuO+C=Cu+CO↑,根据各物质的△G计算,则: △G°2=(-137.3+0)-(127.2+0)= △H-T△S =-10.1(kJ)<0
根据以上计算的△H-T△S均小于零,说明这两个反应都有可能发生。但反应(1)的△H-T△S更负,因此反应按照(1)式进行的趋势占优势,说明C还原CuO的反应里,将C的氧化产物写成CO2更合理。实验结果表明C的氧化产物也是CO2。 对于C还原SiO2,我们也可以做相似的定量研究: 1、如果反应为SiO2+C=Si+CO2↑,则:△G°3=(-394.4+0)-(-805.0+0)=△H-T△S =-394.4+805.0=410.6(kJ)>0
焓的概念是根据热力学第一定律引入的,规定在等温等压且不做非体积功的条件下,反应的热效应就等于反应的焓变,对于一定压且不做非体积功条件下的化学反应的热效应也等于产物的是焓值(末态)减去反应物的总焓值(始态)。在研究各种体系的变化过程时,人们发现自然界的自发过程一般都朝着能量降低的方向进行。显然,能量越低,体系的状态就越稳定。化学反应一般亦符合上述能量最低原理。的确,很多放热反应,在298K、标准态下是自发的。例如:
3Fe(s) + 2O2(g)=Fe3O4(s); △H (298 K)= -1118.4 kJ·mol-1 C(s) + O2(g)=CO2(g); △H(298 K) =-393.509 kJ·mol-1 CH4(g) + 2O2(g)=CO2(g) + 2H2O(l); △H(298 K) = -890.36 kJ·mol-1
此有人曾试图以298K、标准态下反应的焓变作为反应自发性的判据。认为在等温等压条件下,当
△H < 0时:化学反应自发进行 △H > 0时:化学反应不能自发进行
但是,实践表明:有些吸热过程(△H >0)亦能自发进行。例如,水的蒸发,NH4Cl溶于水以及Ag2O的分解等都是吸热过程,但在298K、标准态下均能自发进行:
NH4Cl(s) = NH4+(aq) + Cl-(aq); △H (298 K)= 14.7 kJ·mol-1 Ag2O(s) = 2Ag(s) + 1/2O2(g); △H (298 K)= 31.05 kJ·mol-1
CaCO3(s) = CaO(s) + CO2(g); △H (298 K)= 178.32 kJ·mol-1
对于CaCO3的分解反应 在298K、标准态下反应是非自发的。但当温度升高到约1123K时,CaCO3的分解反应就变成自发过程,而此时反应的焓变仍近似等于178.32kJ·mol-1,(温度对焓变影响甚小)。由此可见,把焓变作为反应自发性的普遍判据是不准确、不全面的。因为除了反应焓变以外,体系混乱度的增加和温度的改变,也是许多化学和物理过程自发进行的影响因素。
焓变(焓判据)只能判断 ,熵变(熵判据)只能判断 。
思考:下表列入了反应的自发性的一些情况。
|
反应热 |
熵值 |
所属反应的自发性 |
反应举例 |
|
放热
放热
吸热
吸热 |
增大
减小
增大
减小 |
任何温度都自发进行
较低温时自发进行
高温时自发进行
任何温度都不能自发进行 |
2H2O2(l)=2H2O(l)+O2(g)
N2(g)+3H2(g)=2NH3(g)
CaCO3(s)=CaO(s)+CO2(g) |
结论:二者的复合判据才是自以反应的判断标准。二者对反应方向的影响存在着关系:
⊿H-T⊿S<0 正反应自发进行;⊿H-T⊿S>0 逆反应自发过行。
疑难点拨
熵指的是 ,用 表示。作为固液气三态的熵值比较大小顺序为 。
思考:为何物质的溶解是自发过程?(请用熵变来解释)(通过分子扩散自发形成均匀混合物。物质溶于水自发地向水中扩散,形成均匀的溶液,体系有由有序自发地变为无序的倾向)。
思考:看你找出的规律是否正确?
|
化学反应 |
⊿S(KJ﹒mol-1﹒K-1) |
|
2H2O2(aq)=2H2O(l)+O2(g) |
57.16 |
|
NH4HCO3(s)+CH3COOH(aq)=CO2(g)+CH3COONH4(aq)+H2O(l) |
184 |
|
CaCO3(s)=CaO(S)+CO2(g) |
169.6 |
|
C(s, 石墨)+H2O(g)=CO2(g)+H2(g) |
133.8 |
|
2Al(s)+Fe2O3(s)=Al2O3(s)+2Fe(s) |
-39.35 |
结论:熵值作为判断反应自发性的依据:在化学变化中,体系趋向于最大无序的方向进行。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com