
1、沉淀的溶解
溶解沉淀的方法:(1)加入足量的水(2)使沉淀转化为气体(3)使沉淀转化为弱电解质
2、外因:遵循平衡移动原理
(1)浓度:加水,平衡向溶解方向移动。
(2)温度:升温,多数平衡向溶解方向移动。
练习3:试用文字描述生成氯化银反应达到沉淀溶解平衡的过程,并根据该过程中各反应粒子的变化情况(如最大、变大等)填下下表。
|
|
C(Ag+) |
C(Cl_) |
m(AgCl) |
|
反应初始 |
|
|
|
|
达到溶解平衡前 |
|
|
|
|
达到溶解平衡时 |
|
|
|
练习4:下列说法中正确的是C
A、物质的溶解性为难溶,则该物质不溶于水
B、不溶于水的物质溶解度为0
C、绝对不溶解的物质是不存在的
D、某粒子被沉淀完全是指该粒子在溶液中的浓度为零
0.01 0.1 m(g)
(1)绝对不溶的电解质是没有的。(2)同是难溶电解质,溶解度差别也很大。(3)易溶电解质做溶质时只要是饱和溶液也可存在溶解平衡。
1、内因:电解质本身的性质
难溶 微溶 易溶



6.沉淀的转化是__ _____ __的过程,其实质是__ _____ _ __。
当Qc 大于 Ksp时,情况为:__ _____ _ __
当Qc 等于 Ksp时,情况为:__ _____ _ __
当Qc 小于 Ksp时,情况为:__ _____ _ __
5.溶度积KSP反映了难溶电解质在水中的__ ______ ___,KSP的大小和溶质的溶解度不同,它只与__ ______ 有关,与__ ______ 无关。利用溶度积KSP可以判断__ ______ __、__ ______ __以及__ _____ _ __。
4.难溶电解质在水中存在沉淀溶解平衡,其平衡常数称为_______ __,简称_______ __。请写出PbI2 Cu(OH)2 BaSO4 CaCO3 Al(OH)3 CuS的沉淀溶解平衡与溶度积KSP表达式
3、表达式:如 NaCl(s)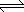 Na+(aq)+Cl-(aq)
Na+(aq)+Cl-(aq)
练习1:下列对沉淀溶解平衡的描述正确的是B
A、反应开始时,溶液中各离子浓度相等。
B、沉淀溶解平衡达到平衡时,沉淀的速率和溶解的速率相等
C、沉淀溶解平衡达到平衡时,溶液中溶质的离子浓度相等,且保持不变。
D、沉淀溶解平衡达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解。
练习2:向有固态氢氧化镁存在的饱和溶液中,分别加入固体醋酸钠、氯化铵时,固体氢氧化镁的质量有什么变化?增加 减少
2、特征:等、动、定、变。
1、定义:一定条件下,强电解质溶解成离子的速率等于离子重新结合成沉淀的速率,溶液中各离子的浓度保持不变的状态。(也叫沉淀溶解平衡)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com