
5.除去FeCl3溶液中的Fe(OH)3胶体,可行的方法是
A.过滤 B.蒸发 C.加入适量的盐酸 D.加入适量的NaOH溶液
4.下列物质不属于盐类的是
A.纯碱 B.烧碱 C.小苏打 D.灰锰氧
3.下列物质的水溶液能导电,但该物质属于非电解质的是
A.Cu B.HCl C.CO2 D.CH3CH2OH(乙醇)
2、将饱和FeCl3溶液分别滴入下列液体中,能形成胶体的是
A、冷水 B、沸水 C、NaOH溶液 D、NaCl溶液
1、根据中央气象台报道,近年每到春季,我国沿海一些城市多次出现大雾天气,致使高速公路关闭,航班停飞。雾属于下列分散系中的
A、溶液 B、悬浊液 C、乳浊液 D、胶体
3、离子共存的问题
(1)生成难溶或微溶物质不能大量共存。例如:Ag+与Cl-、Ca2+与CO32-、Ba2+和SO42-等。
(2)强酸中不共存的离子有氢氧根和弱酸的酸根,如:ClO-、F-、S2-、HSO3-、AlO2-、PO43-、HS-、H2PO4-、CO32-、SiO32-等。
(3)强碱中不共存的离子有:氢离子和弱碱的阳离子,如:NH4+、Fe3+、Cu2+、Al3+、Mg2+等以及弱酸的酸式酸根,如:HCO3-、HSO3-、HPO42-、HS-等。
(4)发生氧化还原反应的离子不能大量共存,如:Fe3+与S2-、I-; MnO4-与S2-、I-、SO32-、Fe2+;H+和NO3-与S2-、I-、Fe2+等。
考题回顾
[例1](2004江苏)Cl2是一种消毒杀菌效率高、二次污染小的水处理剂。实验室可通过以下反应制得ClO2:2KCl O3+H2C2O4+H2 SO4===2 ClO2↑+K2 SO4+2CO 2 ↑+2H2 O 下列说法正确的是
A.KCl O3在反应中得到电子 B.ClO2是氧化产物
C.H2C2O4在反应中被氧化 D.1mol KCl O3参加反应有2mol电子转移
解析:由反应方程式看出KCl O3中Cl元素的化合价由+5降到了+4,所以A正确,D错误;B错误,ClO2应是还原产物;H2C2O4中C元素的化合价由+3升到CO 2中的+4,H2C2O4被氧化正确。本题关键要记清氧化剂、还原剂、还原产物、氧化产物之间的关系。答案:AC。
[例2](2002上海卷)在氯氧化法处理的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一)氰酸盐进一步被氧化为无毒物质。
(1) 某厂废水中含KCN,其浓度为650 ml·L-1,现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2→KOCN+2KCl+H2O,被氧化的元素是_______
(2)投入过量的液氯,可将氰本盐是一步氧化为氮敢。请配平下列化学方程式:___KOCN+__KOH+___Cl2=___CO2+___N2+____KCl+___H2O
(3)若处理上述废水20L,使KCN完全转化为无毒物质,至少需液氯________g
解析:(1)此题关键是判断元素前后价态的变化,氯元素化合价降低。K、H、O三元素化合价未变,所以变化的是碳(升高)。(2)首先分清还原剂是KOCN,氧化剂是Cl2,再配平其计量数。(3)在完成(1)(2)的基础上找出关系式2KCN~3Cl进行计算。此题主要是考查氧化还原反就的概念、配平及有关多步反应的计算,此题是一信息题,与实际生活相联系,思考量大,有效地考查了学生分析问题的能力,增强学生的环保意识,是今后命题的方向。
答案:(1)碳(或C) (2)2KOCN+4KOH+3Cl2→2CO2+N2+ 6KCl+2H2O (3)35.5
[例3](2002年上海,19)下列离子方程式书写正确的是
A.FeCl2溶液中通入Cl2: Fe2++Cl2=Fe3++2Cl-
B.澄清石灰水与少量小苏打溶液混合: Ca2++OH-+HCO3-=CaCO3↓+H2O
C.FeS固体放入稀硝酸溶液中: FeS+2H+=Fe2++H2S↑
D.AlCl3溶液中加入过量氨水: Al3++4OH-=AlO2-+2H2O
解析:A选项电荷不守恒,正确的是2Fe2++Cl2=2Fe3++2Cl-;C选项中未考虑稀硝酸的氧化性,导致产物有误;D选项中氨水是弱电解质,在离子方程式中应写化学式,同时Al(OH)3也不溶于过量的氨水,正确的是Al3++3NH3·H2O=Al(OH)3↓)+2NH4+。答案:B
思维启迪:澄清石灰水若与足量小苏打溶液混合,离子方程式是________________。
答案: Ca2++2OH-+2HCO32-=CaCO3↓+CO32-+2H2O
[例4](2002年上海,9)在pH=1的无色溶液中能大量共存的离子组是
A.NH4+、Mg2+、SO42-、Cl- B.Ba2+、K+、OH-、NO3-
C.Al3+、Cu2+、SO42-、Cl- D.Na+、Ca2+、Cl-、AlO2-
解析:pH=1表明溶液呈较强的酸性,在酸性溶液中不存在大量的OH-,C项因Cu2+呈蓝色而不符合题意要求,D项中因AlO2-在酸性溶液中发生AlO2-+H++H2O=Al(OH)3或AlO2-+4H+=Al3++2H2O而不能大量共存.审视各项,只有A项符合题意.答案:A。
思维启迪:在溶液中NO3-几乎与所有的离子能大量共存,如:NO3-与H+、NO3-与Al3+、NO3-与Fe2+等,请思考在pH=1的溶液中NO3-、Cl-、Fe2+、K+能否大量共存?答案:不能大
量共存。
[例5]有甲、乙两相邻的工厂,排放的污水经初步处理后只溶有:Ag+、Ba2+、Fe3+、Na+、Cl-、SO42-、NO3-、OH-中的各不相同的4种离子.若单独排放会造成环境污染.如将两厂的污水按适当比例混合,沉淀后,污水转变成无色澄清的硝酸钠溶液排出,则污染程
度大为降低,现又测得甲厂的污水pH>7,试推断:
(1)甲厂污水中含有的4种离子是____________________.
(2)乙厂污水含有的4种离子是____________________.
解析:环境保护是目前考试的热点内容.本题实质考查的是离子共存问题,甲厂的污水中含OH-,则一定不含Ag+和Fe3+,即乙厂污水中含Ag+和Fe3+,不能含Cl-和SO42-,由
此进而推得: 甲厂污水中的离子是OH-、Cl-、SO42-、Na+; 乙厂污水的离子是Ag+、Fe3+、Ba2+、NO3-. 答案: (1)OH-、Cl-、SO42-、Na+ (2)Ag+、Fe3+、Ba2+、NO3-
[例6]含有农药、染料、酚、氰化物,以及引起色度、臭味的废水,常用化学氧化法进行处理,所用的氧化剂有氯类(如液氯、次氯酸钙、次氯酸钠等)和氧类(如空气、臭氧、过氧化氢、高锰酸钾等)。一个典型实例是用氯氧化法处理含有剧毒的氰化物(含CN-)的废水.在碱性条件
下(pH=8.5-11),氯气可将氰化物中CN-氧化为只有它毒性1/1000的氰酸盐(含CNO-)。
(1)写出含CN-废水用氯气氧化生成氰酸盐的离子方程式____________________.
(2)若向含CNO-的废水中再通入氯气,可使CNO-转化为无毒的气体,写出这个反应的离子方程式____________________.
(3)在用液氯不便的地区,可用漂白粉处理含CN-的废水,若将其氧化为CNO-,其离子方程式为__________________________________________________.
解析:(1)CN-是在碱性条件下被Cl2氧化的,故反应物应有OH-参加,产物除生成氰酸盐外
还应有Cl-及H2O,离子方程式为:CN-+Cl2+2OH-=CNO-+2Cl-+H2O。
(2)当Cl2过量时(1)中的产物CNO-与Cl2反应,碱性条件下不可能产生CO2及其他气
体,而碳元素的存在形式为CO32-,无毒气体一定为N2,离子方程式: 2CNO-+3Cl2+8OH-=2 CO32-+6Cl-+4H2O+N2↑
(3)由于漂白粉中的ClO-具有强氧化性,故可发生反应:CN-+ClO-=CNO-+Cl-
答案:(1)CN-+Cl2+2OH-=CNO-+2Cl-+H2O(2)2CNO-+3Cl2+8OH-=2 CO32-+6Cl-+4H2O+N2↑ (3)CN-+ClO-=CNO-+Cl-
单元过关测试
2、书写离子方程式注意事项
(1)离子反应是在溶液中或熔融状态时进行的反应,凡非溶液中进行的反应一般不写离子方程式。如:NH4Cl固体和Ca(OH)2固体混合加热,不能写成离子方程式,即:
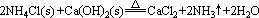
(2)离子方程式中写化学式:
单质、氧化物一律写化学式(Cu、Fe、CuO等);弱酸(HF、H2S、H2SO3、HClO等);弱碱(NH3·H2O等);难溶于水的物质(BaSO4、CaCO3、FeS、Fe(OH)3等)
(3)多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写。如NaHSO3溶液和稀H2SO4反应:HSO3-+H+=H2O+SO2↑
1、氧化还原概念关系:
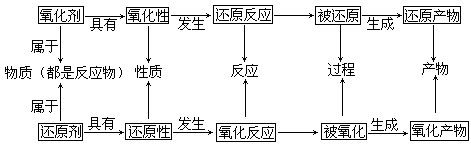
|
单 质 |
金属 |
冶金分类 |
黑色金属 |
Fe,Cr,Mn |
|
有色金属 |
除Fe,Cr,Mn外的金属 |
|||
|
按密度分类 |
轻金属 |
Na,Mg,Al等 |
||
|
重金属 |
Fe,Cu,Hg,Ag等 |
|||
|
常规分类 |
常见金属 |
Fe,Al,Cu等 |
||
|
稀有金属 |
Zr,Nb,Mo等 |
|||
|
非金属 |
有多种不同的分类方式,其中包括稀有气体 |
|||
|
氧 化 物 |
不成盐氧化物 |
NO,CO等 |
||
|
成盐氧化物 |
酸性氧化物 |
SO2,CO2等 |
||
|
碱性氧化物 |
Na2O,CaO等 |
|||
|
两性氧化物 |
Al2O3,ZnO等 |
|||
|
化 合 物 |
碱 |
溶解度大小 |
可溶性碱 |
NaOH等 |
|
难溶性碱 |
Fe(OH)3等 |
|||
|
碱性强弱 |
强碱 |
KOH,NaOH等 |
||
|
弱碱 |
NH3·H2O,Fe(OH)3等 |
|||
|
两性氢氧化物 |
Al(OH)3等 |
|||
|
酸 |
是否含有氧元素 |
含氧酸 |
H2SO4等 |
|
|
无氧酸 |
H2S等 |
|||
|
可电离出H+数目 |
一元酸 |
HCl,HClO等 |
||
|
二元酸 |
H2SO4,H2S等 |
|||
|
多元酸 |
H3PO4等 |
|||
|
氧化性(酸根) |
强氧化性 |
HNO3,浓H2SO4等 |
||
|
非氧化性 |
稀硫酸,盐酸等 |
|||
|
酸性 |
强酸 |
HNO3,H2SO4等 |
||
|
弱酸 |
H2S,HClO等 |
|||
|
盐 |
正盐 |
Na2SO4等 |
||
|
酸式盐 |
NaHSO4等 |
|||
|
碱式盐 |
Cu2(OH)CO3等 |
|||
|
复盐 |
KAl(SO4)2等 |
|||
|
络盐 |
Ag(NH3)2Cl ,Fe(SCN)3等 |
|||
|
有机物 |
有机化学部分再研究 |
|||
|
混合物 |
溶液,胶体,浊液 |
7.向50ml0.018mol/L的AgNO3溶液中加入50ml0.02mol/L的盐酸,生成了沉淀。如果溶液中C(Ag+)和C(Cl-)的乘积是一个常数,C(Ag+)· C(Cl-)=1.0×10-10,当溶液中C(Ag+)· C(Cl-)>常数,则有沉淀产生,反之沉淀溶解,求
(1)沉淀生成后溶液中C(Ag+)是多少?
(2)如果向沉淀生成后的溶液中再加入50mL0.001mol/L的盐酸,是否产生沉淀,为什么?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com