

22.(30分)
 材料一 2008年9月以来,因食用被三聚氰胺污染的石家庄三鹿奶粉而导致多名婴幼儿死亡、数千人患病的结石奶粉事件,在社会上掀起波澜。据了解,三聚氰胺是一种化工原料,作为添加剂,可以使原奶在掺入清水后,仍然符合收购标准,所以被不法分子用来掺杂使假,增加交奶量以图利。事件发生后,国务院相关部门立即进行调查并在全国范围内对同类产品进行专项检查和整治,发现三鹿、伊利、蒙牛、雅士利等22家奶粉中检出三聚氰胺。企业和当地主管部门的有关责任人均被追究相应责任。
材料一 2008年9月以来,因食用被三聚氰胺污染的石家庄三鹿奶粉而导致多名婴幼儿死亡、数千人患病的结石奶粉事件,在社会上掀起波澜。据了解,三聚氰胺是一种化工原料,作为添加剂,可以使原奶在掺入清水后,仍然符合收购标准,所以被不法分子用来掺杂使假,增加交奶量以图利。事件发生后,国务院相关部门立即进行调查并在全国范围内对同类产品进行专项检查和整治,发现三鹿、伊利、蒙牛、雅士利等22家奶粉中检出三聚氰胺。企业和当地主管部门的有关责任人均被追究相应责任。
材料二 三鹿曾经是中国乳业的知名品牌,但是在产品安全问题曝光后企业形象受到严重打击,损失惨重。道德缺失、投机取巧,其结果只能是自掘坟墓。
材料三 受“三鹿”问题奶粉事件的波及,2008年9月20日下午,部分群众赶到某市中心街,要求某品牌奶粉总经销商退款。其间,3名社会闲散人员借机实施打砸行为,该市警方果断处置,依法将3人行政拘留。有同学说,公民有权通过各种方式维护自己的合法权益。
(1)结合材料一、二,谈谈企业经营者应如何防止自掘坟墓?(12分)
(2)结合材料三,请从公民权利和义务的关系角度,对该同学的观点进行评析。(8分)
(3)运用哲学知识结合材料,谈谈政府和企业应从“三鹿”奶粉事件中吸取什么教训?(10分)
21. (10分)李嘉图认为,商品价格的波动使资本恰好按照必要的数量运行,在没有政府的干预时,农业、商业和制造业最为繁荣,需要国家做的全部事情就是避免一切干预。凯恩斯在《就业、利息和货币通论》中指出,在有效需求不足时,单纯的价格机制无法解决经济的萧条与失业问题,对此,政府应积极加强调控。他认为没有国家的积极干预,资本主义就会灭亡。
(10分)李嘉图认为,商品价格的波动使资本恰好按照必要的数量运行,在没有政府的干预时,农业、商业和制造业最为繁荣,需要国家做的全部事情就是避免一切干预。凯恩斯在《就业、利息和货币通论》中指出,在有效需求不足时,单纯的价格机制无法解决经济的萧条与失业问题,对此,政府应积极加强调控。他认为没有国家的积极干预,资本主义就会灭亡。
(1)以上材料反映了李嘉图和凯恩斯的什么观点?(4分)
(2)李嘉图和凯恩斯的观点对我国完善社会主义市场经济体制有什么启示?(6分)
6. (12分)
硝酸发生氧化还原反应的时候,一般硝酸浓度越稀,对应还原产物中氮的化合物越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的HNO3充分反应,反应过程中无任何气体放出。在反应结束后的溶液中,逐滴加入4 mol·L-1NaOH溶液。所加NaOH溶液的体积(mL)与产生沉淀的物质的量(mol)关系如下图所示:
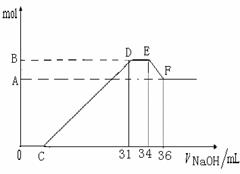
(1)和铝粉和铁粉的混合物反应时,HNO3对应还原产物为---------------------------(填化学式)。
(2)完成下列过程中的离子反应方程式:
O→C_______________________________________________________________;
D→E________________________________________________________________;
E→F_______________________________________________________________;
(3)B值是多少mol?写出计算过程。
5.(14分)
根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,制得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①>35℃NH4HCO3会有分解
请回答:
(1)反应温度控制在30-35℃,是因为若高于35℃,则 ,若低于30℃,则 ;为控制此温度范围,采取的加热方法为
。
(2)加料完毕后,继续保温30分钟,目的是 。静置后只析出NaHCO3晶体的原因是 。用蒸馏水洗涤NaHCO3晶体的目的是除去 杂质(以化学式表示)。
(3)过滤所得的母液中含有 (以化学式表示),需加入 ,并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl。
(4)测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水溶解,加1-2滴酚酞指示剂,用物质的量浓度为c(mol/L)的HCl溶液滴定至溶液由红色到无色(指示CO32-+H+=HCO3-反应的终点),所用HCl溶液体积为V1 mL,再加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液体积为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:NaHCO3(%)=
4.(10分)
(1)航天飞机曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
写出其中涉及到的化学方程式:
;
。
(2)高氯酸铵作为火箭燃料的重要氧载体。高氯酸铵在高压、450℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式 。
②反应中生成的氧化产物与还原产物的物质的量之比是 ,
每分解1mol高氯酸铵,转移的电子数目是 。
3.(12分)工业上用固体硫酸亚铁制取颜料铁红(Fe2O3),反应原理是:
2FeSO4  Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
Fe2O3+SO2↑+SO3↑。某研究性学习小组用下图所示装置检验该反应所产生的气态物质,然后用装置中A瓶内的混合物来测定已分解的FeSO4的质量。
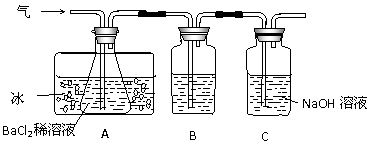 (SO2沸点为-10.02℃)
(SO2沸点为-10.02℃)
请回答相关问题:
(1)A瓶所盛试剂的作用是 ;B瓶所盛的试剂是 ;C瓶所盛试剂的作用是 。
(2)A瓶要用冷水冷却的原因是 。
(3)将此反应生成的气体通入A瓶BaCl2溶液中,则 。(填编号)
A.析出BaSO3沉淀 B.析出BaSO4沉淀
C.逸出SO3气体 D.逸出SO2气体
理由是 。
(4)反应后若用A瓶内的混合物来测定已分解的FeSO4的质量,其实验操作的第一步是(简述操作步骤) 。
2.(10分)实验室用下图的装置将CO2和CO进行分离和干燥.已知a、b均为活塞,试回答
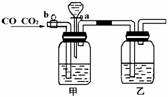
(1)甲瓶中装的是 溶液,乙瓶中装的是 溶液,分液漏斗中装的是 .
(2)当CO2与CO的混和气体通过该装置时,先分离得到的是 ,活塞操作是 ;然后得到 ,活塞操作是 .
1.(10分)
(1)下列有关实验的基本操作及安全知识的叙述,正确的是 (填序号)。
A.附着于试管内壁的苯酚,可用碱液洗涤
B.用结晶法可以除去硝酸钾中混有的少量氯化钠
C.切割白磷时,必须用镊子夹取,置于桌面上的玻璃片上,小心用刀切割
D.实验时,不慎打翻燃着的酒精灯,可立即用湿抹布盖灭火焰
E.浓硫酸不小心沾到皮肤上,立刻用稀烧碱溶液洗涤
F.在氢氧化铁胶体中滴加少量稀硫酸会产生沉淀
(2)下表是某种常见金属的部分性质:
|
颜色状态 |
硬度 |
密度 |
熔点 |
导电性 |
导热性 |
延展性 |
|
银白色固体 |
较软 |
2.70g/cm3 |
660.40C |
良好 |
良好 |
良好 |
将该金属投入冷水中无变化,投人稀盐酸中可产生大量的无色气体。试回答:
①推断该金属可能的一种用途 ,该金属的活动性比铜 (填“强”或“弱”)。
②请自选试剂,设计不同的实验探究该金属与铁的活动性强弱,并完成下表:
|
猜想 |
验证方法 |
预测实验现象 |
|
该金属比铁活泼 |
|
|
|
该金属活泼性比铁弱 |
|
|
6.(2)D(2分)
(3)72×103(2分)
(4)反应SO2+I2+2H2O=H2SO4+2HI(1分)
n(SO2)=n(I2)=20×10-3 L×0.025 mol/L=0.0005 mol(1分)
V(SO2)=0.0005 mol×22.4 L/mol=0.0112 L(1分)
V(SO2)%=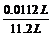 ×100%=0.1%>0.05%,故不能直接排放(1分)
×100%=0.1%>0.05%,故不能直接排放(1分)
(其他合理过程酌情给分)
21A.(12分)
(1)1s22s22p63s23p63d104s24p3或[Ar]3d104s24p3(2分)
(2)4(2分)
(3)BCDE(2分,写对1个得0分,写对2-3个得1分,有错得0分)
(4)三角锥形(2分) sp2(2分)
(5)NH3分子间能形成氢键,而AsH3分子间不能形成氢键(2分,没有强调分子间氢键的得1分,回答分子内氢键的得0分)
21B.(12分)
(1)驱赶其中溶解的CO2,防止滴定时消耗一定量的NaOH溶液,导致测定结果偏高(2分)
(2)偏高(2分)
(3)C(2分)
(4)② 边加边振荡锥形瓶(2分)
④ 当最后一滴NaOH标准溶液滴入,溶液的颜色由无色突然变为粉红色,且在半分钟内不褪色(2分)
(5)4.795 g/100 mL(2分)
20.(10分)
(1)B(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com