
8.根据下列要求,各用电子式表示一实例:
(1)只含有极性键并有一对孤对电子的分子
(2)只含有离子键、极性共价键的物质
(3)只含有极性共价键、常温下为液态的非极性分子
7.氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
(1)写出(CN)2与苛性钠溶液反应的离子方程式_______________________________;
(2)已知氰分子中键与键之间的夹角为180°,并有对称性,
则(CN)2的电子式为____________,结构式为____________________________,
分子空间构型为_______________,是__________分子(填“极性”或“非极性”);
(3)氰分子中碳原子为___________杂化;一个氰分子中包含____________个σ键,_______个π键。
6.下图为周期表中部分元素某种性质(X值)随原子序数变化的关系。
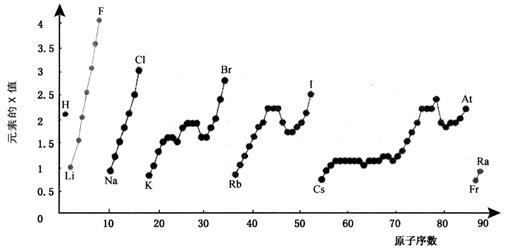
(1)短周期中原子核外p亚层上电子数与s亚层上电子总数相等的元素是______(写元素符号)。
(2)同主族内不同元素的X值变化的特点是_________________________,同周期内,随着原子序数的增大,X值变化总趋势是________________。周期表中X值的这种变化特点体现了元素性质的________________变化规律。
(3)X值较小的元素集中在元素周期表的_____________。
a. 左下角 b. 右上角 c. 分界线附近
(4)下列关于元素此性质的说法中正确的是__________(选填代号)。
a. X值可反映元素最高正化合价的变化规律
b. X值可反映原子在分子中吸引电子的能力
5.A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P亚层中有3个电子。
(1)C原子的电子排布式为
(2)当n=2时,B的原子结构示意图为
(3)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2,元素A在周期表中的位置是 ,A、B、C、D四种元素的第一电离能由大到小的顺序是 (用元素符号表示)。
4.下表是钠和镁的第一、二、三电离能(KJ·mol-1)。
|
元素 |
I1 |
I2 |
I3 |
|
Na |
496 |
4 562 |
6 912 |
|
Mg |
738 |
1 451 |
7 733 |
请试着解释:为什么钠易形成Na+,而不易形成Na2+?为什么镁易形成Mg2+,而不易形成Mg3+?
3.已知各种硝基苯酚的性质如下表
|
名称 |
结构式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
|
邻-硝基苯酚 |
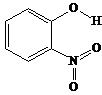 |
0.2 |
45 |
100 |
|
间-硝基苯酚 |
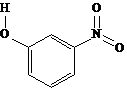 |
1.4 |
96 |
194 |
|
对-硝基苯酚 |
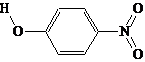 |
1.7 |
114 |
295 |
下列关于各种硝基苯酚的叙述不正确的是 ( )
A.邻-硝基苯酚分子内形成氢键,使其熔沸点低于另两种硝基苯酚
B.间-硝基苯酚不仅分子间能形成氢键,也能与水分子形成氢键
C.对-硝基苯酚分子间能形成氢键,使其熔沸点较高
D.三种硝基苯酚都不能与水分子形成氢键,所以在水中溶解度小
2.下列物质的熔、沸点高低顺序中,正确的是 ( )
A.金刚石 >晶体硅 >二氧化硅 >碳化硅
B.CI4>CBr4>CCl4>CH4
C.MgO>O2>N2>H2O
D.金刚石>生铁>纯铁>钠
1.下列说法正确的是: ( )
A.126g P4含有的P-P键的个数为6NA
B.12g石墨中含有的C-C键的个数为2NA
C.12g金刚石中含有的C-C键的个数为1.5NA
D.60gSiO2中含Si-O键的个数为2NA
2.下表中实线是元素周期表的部分边界,其中上边界并未用实线标出。
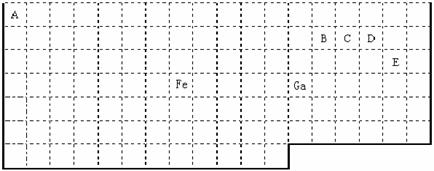
根据信息回答下列问题:
(1)周期表中基态Ga原子的最外层电子排布式为 。
(2)Fe元素位于周期表的 分区;Fe与CO易形成配合物Fe(CO)5,在Fe(CO)5中铁的化合价为__________;已知:原子数目和电子总数(或价电子总数)相同的微粒互为等电子体,等电子体具有相似的结构特征。与CO分子互为等电子体的分子和离子分别为 ____和 _____(填化学式)。
(3)在CH4、CO、CH3OH中,碳原子采取sp3杂化的分子有 。
(4)根据VSEPR理论预测ED4- 离子的空间构型为______________型。B、C、D、E原子相互化合形成的分子中,所有原子都满足最外层8电子稳定结构的电子式为:__________________________________(写3种)
[专题训练]
1.I.短周期某主族元素M的电离能情况如图(A)所示。则M元素位于周期表的第 族。
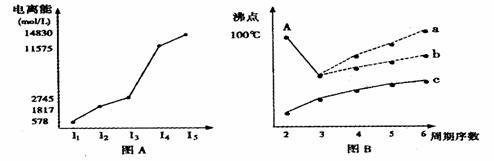
II.图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第 族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线--折线a和折线b,你认为正确的是: ,理由是: 。
 III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
III.人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属则被科学家预测为是钛(Ti)。钛被誉为“未来世纪的金属”。试回答下列问题:
(1)22Ti元素基态原子的价电子层排布式为 。
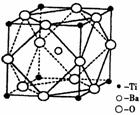
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构示意图如右图,则它的化学式是 。
(3)现有含Ti3+的配合物,化学式为[TiCl(H2O)5]Cl2·H2O。配离子[TiCl(H2O)5]2+中含有的化学键类型是 ,该配合物的配体是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com