
11.(共14分,每空2分) 
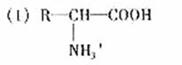
(2)①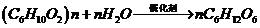 (葡萄糖) ② a、c
(葡萄糖) ② a、c
(3)掩蔽氨基,避免氨基影响羧基和NaOH的中和反应
(4)①洗涤、干燥所得沉淀
②Fe(NO3)3 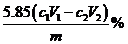

11.(14分)
(1)氨基酸是蛋白质的基石,氨基酸分子中的氨基(-NH2)显碱性。氨基酸往往形成一种两性离子,在水溶液中存在如下平衡:
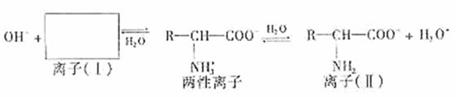
方框内所表示的离子(1)的结构简式是 ▲ 。
(2)谷氨酸的的一钠盐(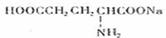 )是味精的主要成分。当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
)是味精的主要成分。当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。
①淀粉发生水解反应的化学方程式是 ▲ 。
②实验室中检验淀粉水解产物应选用的试剂是 ▲ (填字母)
a. NaOH溶液、氨水、AgNO3溶液 b. H2SO4溶液、氨水、AgNO3溶液
c. NaOH溶液、CuSO4溶液 d. H2SO4溶液、CuSO4溶液
(3)“沙伦逊甲醛滴定法”用于测定味精中谷氨酸一钠盐的含量。将一定质量味精样品溶于水,再向溶液中加入36%甲醛溶液,反应为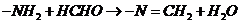 ,再以酚酞为指示剂,用NaOH溶液进行滴定。上述测定过程中加入甲醛的目的是 ▲
,再以酚酞为指示剂,用NaOH溶液进行滴定。上述测定过程中加入甲醛的目的是 ▲
(4)味精中常含食盐,两同学分别设计甲、乙两种方案测定味精中NaCl的含量。
①甲方案;取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,过滤、 ▲ (填缺少的步骤),称量沉淀质量,重复试验3次。
②乙方案:已知AgSCN是难溶于水的沉淀。取mg味精溶于水,加入过量浓度为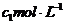 AgNO3溶液,再加入少量 ▲ (填可能的化学式)溶液作指示剂,用浓度为
AgNO3溶液,再加入少量 ▲ (填可能的化学式)溶液作指示剂,用浓度为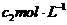 NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为
NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为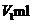 和
和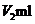 ,则该味精样品中的NaCl的质量分数是 ▲
,则该味精样品中的NaCl的质量分数是 ▲
10、(17分):⑴ 78.3 (2分) ; 100 (1分)
⑵取滤液少许,加入NaOH,加热,生成的气体能使润湿的红色石蕊试纸变蓝(合理即给分) (2分)
⑶Al(OH)3 、Al2O3 、Fe2O3 (3分) ; ⑷K2SO4 、(NH4)2SO4 (2分)
⑸BaCl2 ; 过滤、 洗涤 、干燥 (4分) ; ⑹ (3分)
10、(17分)明矾石是制取钾肥和氢氧化铝的重要原料,明矾石的组成和明矾相似,此外还含有氧化铝和少量氧化铁杂质。具体实验步骤如下图所示:
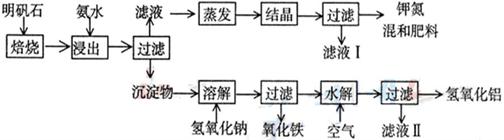 根据上述图示,完成下列问题:
根据上述图示,完成下列问题:
⑴明矾石焙烧后用稀氨水浸出。配制500mL稀氨水(每升含有39.20g氨)需要取浓氨水(每升含有250.28g氨) mL,用规格为 mL量筒量取。
⑵氨水浸出后得到固液混合体系,过滤,滤液中除K+、SO42-外,还有大量的
NH4+。 检验NH4+ 的方法是 。
⑶写出沉淀物中所有物质的化学式 。
⑷滤液 I的成分是水和 。
⑸为测定混合肥料K2SO4、(NH4)2SO4中钾的含量,完善下列步骤:
①称取钾氮肥试样并溶于水,加入足量 溶液,产生白色沉淀。
② 、 、 (依次填写实验操作名称)。
③冷却、称重。
⑹若试样为m g,沉淀的物质的量为n mol,则试样中K2SO4的物质的量为:
mol (用含m、n的代数式表示)
9. (16分)
(1)a、b (2分)
(2)Cl2+2OH-=Cl-+ClO-+H2O (2分)
(3)①否 (1分):HCl+NH3=NH4Cl (2分)
②BDADC (2分);(1分)浓硫酸
防止空气中的水和CO2进入D装置,吸收多余的氨气(2分)
③ [18m(CuO)/m(H2O)]-16 (2分)
9.(16分)氯气、氨气等物质在生产和科研中都有重要应用。
(1) 若发生大量氯气泄漏事故,下列措施中正确的是 。
a.立即通报相关部门,迅速撤离事故现场
b.用蘸有肥皂水的毛巾捂住口鼻立即逆风疏散
c.用蘸有NaOH溶液的毛巾捂住口鼻立即顺风疏散
(2) 事故发生后,可用NaOH稀溶液处理泄漏的氯气,反应的离子方程式是 。
(3) 实验室用氨气还原氧化铜的方法,通过测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)],测定铜的近似相对原子质量。反应的化学方程式是:
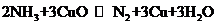 。各选仪器装置如下(装置内所发生的反应是完全的)。
。各选仪器装置如下(装置内所发生的反应是完全的)。
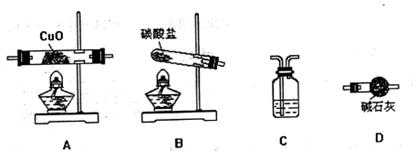
①用上述装置制氨气时,能否将碳酸盐换成氯化铵? (回答“是”或“否”),
用化学方程式说明理由。 。
②仪器从左到右的连接顺序(用字母编号表示,仪器可重复使用)是 。
C中的试剂是 ,其作用是 。
 ③铜的相对原子质量是
[用含有m(Cuo)、m(H2O)的式子表示]。
③铜的相对原子质量是
[用含有m(Cuo)、m(H2O)的式子表示]。
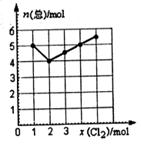
(4) Cl2与NO2在一定条件下发生化合反应,生成一种气体,实验数据如图。图中横坐标是加入C12的物质的量,纵坐标是反应后气体物质的量总和。已知所取C12 、NO2的物质的量总和为6 mol。则生成物的化学式是 。
8.(14分)(其中(3)、(4)、(7)每空2分,余下每空各1分)
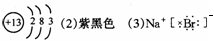
(1)钠 、 3 、ⅡA 、 Al
(4)2F2+2H2O═4HF+O2
(5)He (6)NaOH HF (7)Al(OH)3+OH-═AlO-2+2H2O
8.(14分)有A、B、C、D、E、F、G七种元素,试按下述所给的条件推断。
①A、B、C是同一周期的金属元素,已知原子核外有3个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C。
②D、E是非金属元素,它们跟氢化合可生成气态氢化物HD和HE,在室温时,D的单质是液体,E的单质是固体。
③F在常温下是气体,性质稳定,是除氢外最轻的气体。
④G是除氢外原子半径最小的元素(不考虑稀有气体)。
(1)A的名称 ;B位于周期表中第__周期,第 族;C的原子结构示意图是 。
(2)E的单质颜色是 。
(3)A元素与D元素形成的化合物的电子式是 。
 (4)G的单质与水反应的化学方程式是
。(5)F的元素符号是
。
(4)G的单质与水反应的化学方程式是
。(5)F的元素符号是
。


 (6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的物质的化学式是
;气态氢化物最稳定的物质的化学式是
。
(6)在上述七种元素中,最高价氧化物对应的水化物碱性最强的物质的化学式是
;气态氢化物最稳定的物质的化学式是
。

 (7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是
。
(7)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中反应的离子方程式是
。
7.下列各组离子,无论是在强酸性环境还是在强碱性环境均可大量共存的是 ( D )
A.Na+、K+、HCO3-、NO3- B.Ba2+、Mg2+、SO42-、Cl-
C.Ag+、K+、Na+、NO3- D.K+、Na+、NO3-、Cl-
6.高铁酸钾(K2FeO4)是一种新型、高效、多功能水处理剂,是比Cl2、O3、ClO2、KMnO4
氧化性更强,无二次污染的绿色处理剂。工业是先制得高铁酸钠,然后在低温下,在高
铁酸钠溶液中:
湿法制备的主要反应方程为: Fe(OH)3+ ClO-+ OH-=== FeO42-+ Cl-+ H2O
干法制备的主要反应为: FeSO4+ Na2O2=== Na2FeO4+ Na2O+ Na2SO4 + O2↑(均未配平)下列有关说法不正确的是 ( C )
A.高铁酸钾中铁显+6价
B.湿法中每生成1 mol Na2FeO4转移3 mol电子
C.干法中每生成1 mol Na2FeO4转移4 mol电子
D.K2FeO4处理水时,不仅能消毒杀菌,还能除去水体中的H2S、NH3等,生成的
Fe(OH) 3还能吸附水中的悬浮杂质
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com