
2.已知直线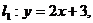 直线
直线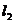 与
与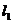 关于直线
关于直线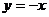 对称,直线
对称,直线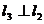 ,则
,则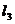 的斜率为( )
的斜率为( )
(A)  (B)
-
(B)
-
(C) -2 (D) 2
1.直线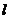 经过点A(2,1)、B(1,
经过点A(2,1)、B(1,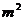 ) (
) (
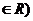 两点,那么直线
两点,那么直线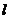 的倾斜角的范围是( )
的倾斜角的范围是( )
(A) 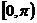 (B)
(B)
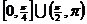
(C) 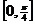 (D)
(D)
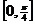
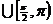
11、
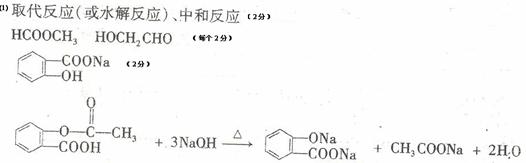
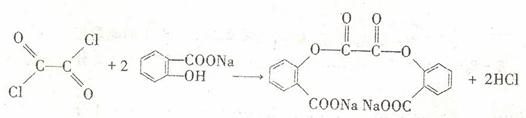
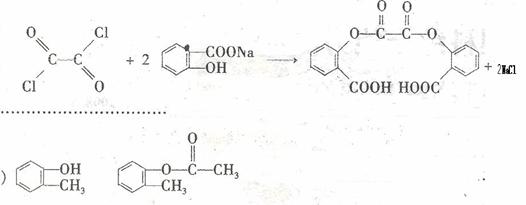

11. (16分)A为药用有机物,A的转化关系如图16所示。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上,D能跟
(16分)A为药用有机物,A的转化关系如图16所示。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上,D能跟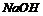 溶液反应。
溶液反应。
请回答:
(1) A转化为B、C时,涉及到的反应类型有 、 。
(2) E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q 、R 。
(3) D的结构简式为 。
(4) 写出A在加热条件下与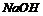 溶液反应的化学方程式
溶液反应的化学方程式
(5) 已知:酰氯能与含有羟基的物质反应生成酯类物质,例如:
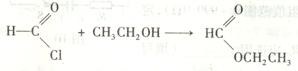
+ 。写出草酰氯(分
。写出草酰氯(分
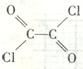
子式C2O2Cl2),结构式 与足量有机物D反应的化学方程式
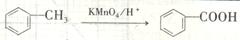
(6)已知:
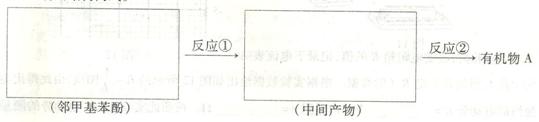 请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。
请选用适当物质设计一种合成方法,用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。
10.每空2分,共16分。
(1)① D ② 3Cu+8H++2NO3-===3Cu2++4H2O+2NO↑
(2)NO2、NO; B
(3)① 氧化 Cu+H2O2+2HCl=CuCl2+2H2O
② Cu+2HCl电解CuCl2+H2↑ ;
10.(16分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜的反应情况,回答下列问题:
(1)①在100mL 18mol/L的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是_________
A.40.32L B.30.24L C.20.16L D.6.72L
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,
请判断该方案是否可行?若不可行,请说明原因。若可行,请写出反应的离子
方程式_____________________________________________________________。
(2)若将过量铜粉与一定量浓硝酸反应,当反应完全停止时,共收集到的气体1.12L
(标准状况),则该气体的成分是__________________。则反应中所消耗的硝酸的物质的量可能为
A.0.1mol B.0.15mol C.0.2mol D.0.25mol
(3)①甲同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物
只有氯化铜和水。则在该反应中,H2O2是作用是_________剂,该反应的化学
方程式为 。
②乙同学提出,设计一个常见的实验装置,在一定条件下,不需再外加化学试
剂,就能将铜溶解在盐酸中。请写出该反应的化学方程式:
_____________________________________________,并画出相应的装置图。
9.(10分)
(1)C2(SO3)/[ C2(SO2)×C2(O2)]
(2)增大 增大 减小(各1分)
(3)15min~20min 25min~30min(2分)
(4)增加了0.04mol O2 AB(各2分)
9.(10分)在一定条件下,二氧化硫和氧气发生如下反应:
 2SO2(g)+ O2 (g) 2SO3(g) △H<0
2SO2(g)+ O2 (g) 2SO3(g) △H<0
(1)写出该反应的化学平衡常数表达式
K= ;
(2)降低温度,该反应K值 ,
二氧化硫转化率 ,
化学反应速度 。
(以上均填增大、减小或不变)
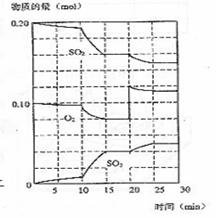
(3)600℃时,在一密闭容器中,将二氧化
碳和氧气混合,反应过程中SO2、O2、
SO3物质的量变化如图,反应处于平衡
状态的时间是 。
(4)据图判断,反应进行至20min时,曲线发生变化的原因是 (用文字
表达);10min到15min的曲线变化的原因可能是 (填写编号)。
A.加了催化剂 B.缩小容器体积
C.降低温度 D.增加SO3的物质的量
8. (16分)
(1)a (2分)
(2)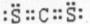 (2分); 直线型 (2分)
(2分); 直线型 (2分)
(3)①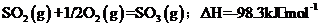
②纯氧中,O2浓度大,单位时间内放热多,体系温度高,平衡向SO3分解的方向移动。(2分)
③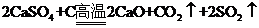 (3分)
(3分)
(4)67.2% (3分)
8.(16分)X、Y、Z为周期表中前20号主族元素,原子序数递增,X、Y原子的最外层电子数是其电子层数的2倍,Z是人体含量最高的金属元素。
(1) 下列含氧酸根化学式书写不正确的是 (填序号)。
a.X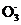 b.X
b.X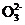 C.Y
C.Y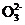 d.Y2
d.Y2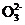
(2) X、Y的原子可构成只含极性键的非极性分子,它的电子式是 ,
空间构型是 。
(3) Y的最高价含氧酸是重要的化工产品。
①己知YO2被空气氧化,每生成1mol气态YO3,放出98.3kJ热量,该反应的热化
学方程式是 。
②实验测得相同条件下一定量的Y单质分别在空气和在氧气中充分燃烧后产物的
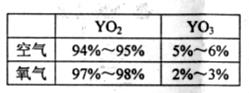 成分(体积分数)如表。Y在纯氧中燃烧产
成分(体积分数)如表。Y在纯氧中燃烧产
物里YO3含量比空气中少的原因是 。
③天然ZYO4既可用于制备Y的氧化物又可用于制水泥。ZYO4与X单质在高温下反应,得到两种常见气体。每消耗1 molX单质,有4 mol电子转移,该反应的化学方程式是 。
(4) 为了测定某水泥样品成分,称取10.0g样品,将其中的Z元素转化为ZX2O4沉淀,将沉淀用稀酸处理得H2X2O4溶液,取该溶液体积的1/100,用KMnO4溶液滴定(氧化产物为XO2,还原产物为Mn2+),结果用去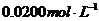 。的KMnO4溶液24.00mL。该样品中Z的氧化物的质量分数是
。
。的KMnO4溶液24.00mL。该样品中Z的氧化物的质量分数是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com