
14.2.80g铁与100mL稀硝酸混合后充分反应,产生气体为NO,反应后铁、硝酸均无剩余。向反应后的溶液中加入100mL0.2 mol·L-1的碘化钾溶液,恰好将溶液中的Fe3+全部还原。求原硝酸溶液的物质的量浓度。
感悟高考:1、A、2、A
例1:A 例2:B 例3:AD 例4:B 例5:B 例6:B
课时作业:
13.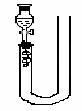 铜与稀硝酸反应产生NO,但由于装置中空气的存在,影响实验现象的观察。为了证明反应中产生的是NO,有一位同学设计了如图所示的装置,根据图示填空。
铜与稀硝酸反应产生NO,但由于装置中空气的存在,影响实验现象的观察。为了证明反应中产生的是NO,有一位同学设计了如图所示的装置,根据图示填空。
(1)将有关操作补充完全:
①将分液漏斗活塞打开,从U型管的长管口慢慢加入稀硝酸,
一直加到 为止。
②关闭活塞,用酒精灯在 一侧加 热。
(2)积极思考,回答下列问题:
①反应到什么时候,该反应会自动停止?
②可以在 位置观察到无色的NO气体。
③如果将分液漏斗活塞慢慢打开,可以观察到的现象为
④如果将活塞再关闭,又可看到的现象为
12.在通常状况下,NO2和SO2易发生反应生成NO和SO3,该反应为不可逆反应。现将NO和SO2的混合气体通入容积为100mL的容器中,充满后,用带有导管的塞子密封。
(1)向容器中通入氧气的体积x在 数值范围内才能保持容器内的压强不变。
(2)要使容器内只含有NO2和SO3两种气体,必须通入氧气 mL;
(3)若向容器中通入40mL氧气后才开始出现红棕色,且不褪色,则原混合气体中,NO的体积为 mL。(气体体积均在同温同压下测定,此时SO3为气体,且不考虑NO2和N2O4的相互转变)
11.一无色干燥的混合气体,可能是由HCl、NO、NO2、CO2、NH3、H2、O2、Cl2中的几种混合而成,根据①把混和气体通过浓H2SO4时,气体体积明显减小。②再通入过量碱石灰时,体积又明显减小;③剩余气体接触空气时,立即变为红棕色,可得:混和气体中一定存在______________,一定不存在_______________,可能存在_________ 。
10.在相同状况下,将下列四种混合气体:①体积比为3 : 1的NH3和N2 ②体积比为 1 : 1的NO2和N2 ③体积比为1 : 1的NO2和O2 ④体积比为4 : 1的NO2和O2,分别置于相同的四支试管中并倒置于水槽中,充分反应后液面上升高度分别为h1、h2、h3、h4,下列关系正确的是
A、h1>h2>h3>h4 B、h4>h3>h2>h1
C、h4>h1>h3>h2 D、h2>h3>h1>h4
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
|
|
|
|
|
|
|
|
|
9.(江苏高考)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。其反应原理为:C3N3(OH)3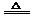 3HNCO; 8HNCO+6NO2
3HNCO; 8HNCO+6NO2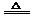 7N2+8CO2+4H2O
7N2+8CO2+4H2O
下列说法正确的是
(A)C3N3(OH)3与HNCO为同一物质 (B)HNCO是一种很强的氧化剂
(C)1 mol NO2在反应中转移的电子为4 mol (D)反应中NO2是还原剂
8.a L CO2气体通过足量Na2O2后所得气体再与b L NO混合时,可得到c L气体(气体体积均在相同状况下测定)。下列表达式错误的是
A.若a < b,则c < 1/2(a + b) B.若a < b,则c> 1/2(a + b)
C.若a > b,则c = 1/2 (a + b) D.若a = b,则c = 1/2(a + b)
7.已知氮的氧化物跟N aOH溶液发生的化学反应如下:
3NO2+2NaOH====2NaNO3+NO↑+H2O NO2+NO+2NaOH====2NaNO2+H2O
现有m molNO2和n mol NO 组成的混合气体,需用a mol/L NaOH溶液吸收且无气体剩余,则需此NaOH溶液的体积是
A、 m/a L B 、2m/3a L C、 2(m+n)/3a L D、 (m+n)/a L
6.常温下,在VL密闭容器中有amolNO气体,压强为bKPa,若再充入amolO2,保持温度不变,反应后容器内的压强是
A、等于1.5bKPa B、等于2bKPa C、小于1.5bKPa D、大于1.5bKPa
5.盛有NO 和 NO2 的混合气体的量筒倒立在盛有水的水槽中,过一段时间后,量筒内的气体体积减小为原来的一半 。则原混合气体中NO 和 NO2 的体积比是
A.3∶1 B.1∶3 C.2∶1 D.1∶2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com