
2.向100 mL 0.5 mol·L-1的AlCl3溶液中加入金属钠完全反应,得到澄清溶液,则加入金属钠的质量至少是 ( )
A..1.15 g B.2.3 g
C..3.45 g D.4.6 g
1.设NA表示阿伏加德罗常数的值,下列叙述正确的是 ( )
A.常温常压下4.6gNO2和N2O4混合气体所含原子总数为0.3NA
B.100mL 2mol/L的NaCl溶液中含溶质分子数为0.2NA
C.将标准状况下11.2L的Cl2通入足量水中发生反应,转移的电子总数为0.5NA
D.等物质的量的N2和CO所含分子数均为NA
31、(本题共11分)
(1)48
(2)m(Na2CO3·10H2O) = 572g
(3)
① 2NO2 + Na2CO3 → NaNO2 + NaNO3 + CO2↑ △m = 48g
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ △m = 32g
设由NO2与纯碱反应产生的CO2为amol
由NO和NO2与纯碱反应产生的CO2为bmol
或
n(NaNO2):n(NaNO3) = 5:3
②设生成的n(NaNO2)为5x mol,n(NaNO3)为3x mol
据Na+守恒:5x + 3x = 4 x = 0.5
m(NaNO2) = 172.5g,m(H2O)余 = 1000×78.8% - 688 = 100g
析出:m(NaNO2)(最大)=172.5 – 71.2 = 101.3g
31、(05上海)酸工业生产中的尾气可用纯碱溶液吸收,有关的化学反应为:
2NO2 + Na2CO3 → NaNO3 + NaNO3 + CO2↑ ①
NO + NO2 + Na2CO3 → 2NaNO2 + CO2↑ ②
(1)根据反应①,每产生22.4L(标准状况下)CO2,吸收液质量将增加 g。
(2)配制1000g质量分数为21.2%的纯碱吸收液,需Na2CO3·10H2O多少克?
(3)现有1000g质量分数为21.2%的纯碱吸收液,吸收硝酸工业尾气,每产生22.4L(标准状况)CO2时,吸收液质量就增加44g。
① 计算吸收液中NaNO2和NaNO3物质的量之比。
② 1000g质量分数为21.2%的纯碱在20℃经充分吸收硝酸工业尾气后,蒸发掉688g水,冷却到0℃,最多可析出NaNO2多少克?(0℃时,NaNO2的溶解度为71.2g/100g水)
28.(1)样品重,砝码轻
(2)防止空气中的CO2和水气进入U型管中
(3)偏高
(4)把反应中的CO2全部导入U型管中
(5)判断反应中的CO2是否全部排出,并被U型管中的碱石灰吸收
(6)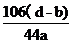 ×100%
×100%
(7) 取一定量的纯碱试样,溶入适量的蒸馏水中,加入足量的BaCl2溶液,过滤、洗涤、干燥、称量滤渣(BaCO3) (或其它合理答案)
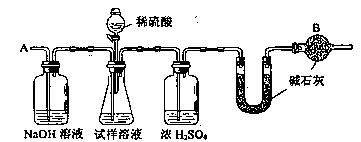
28.(05全国卷I)已知某纯碱试样中含有NaCl杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。
主要实验步骤如下:
① 按图组装仪器,并检验装置的气密性
② 将a g试样放入锥形瓶中,加适量蒸馏水溶解,得到试样溶液
③ 称量盛有碱石灰的U型管的质量,得到b g
④ 从分液漏斗滴入6mol·L-1的硫酸,直到不再产生气体时为止
⑤ 从导管A处缓缓鼓入一定量的空气
⑥ 再次称量盛有碱石灰的U型管的质量,得到c g
⑦ 重复步骤⑤和⑥的操作,直到U型管的质量基本不变,为d g
请填空和回答问题:
⑴ 在用托盘天平称量关品时,如果天平的指针向左偏转,说明________________________。
⑵ 装置中干燥管B的作用是___________________________________________。
⑶ 如果将分液漏斗中的硫酸换成浓度相同的盐酸,测试的结果_________________(填偏高、
偏低或不变)。
⑷ 步骤⑤的目的是__________________________________________。
⑸ 步骤⑦的目的是__________________________________________。
⑹ 试样中纯碱的质量分数的计算式为___________________。
⑺ 还可以用其它实验方法测定试样中纯碱的质量分数。请简述一种不同的实验方法。
28.⑴ NH4HCO3分解
反应速率降低
水浴加热
⑵ 使反应充分进行
NaHCO3的溶解度最小
NaCl NH4Cl NH4HCO3
⑶ NaHCO3 NaCl NH4Cl NH4HCO3
HCl
⑷ 
28.(05天津)根据侯德榜制碱法原理并参考下表的数据,实验室制备纯碱Na2CO3的主要步骤是:
将配制好的饱和NaCl溶液倒入烧杯中加热,控制温度在30-35℃,搅拌下分批加入研细
的NH4HCO3固体,加料完毕后,继续保温30分钟,静置、过滤得NaHCO3晶体。用少量
蒸馏水洗涤除去杂质,抽干后,转入蒸发皿中,灼烧2小时,得Na2CO3固体。
四种盐在不同温度下的溶解度(g/100g水)表
|
温度 盐 溶解度 |
0℃ |
10℃ |
20℃ |
30℃ |
40℃ |
50℃ |
60℃ |
100℃ |
|
NaCl |
35.7 |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
39.8 |
|
NH4HCO3 |
11.9 |
15.8 |
21.0 |
27.0 |
-① |
- |
- |
- |
|
NaHCO3 |
6.9 |
8.1 |
9.6 |
11.1 |
12.7 |
14.5 |
16.4 |
- |
|
NH4Cl |
29.4 |
33.3 |
37.2 |
41.4 |
45.8 |
50.4 |
55.3 |
77.3 |
①> 35℃NH4HCO3会有分解
请回答:
⑴ 反应温度控制在30-35℃,是因为若高于35℃,则_________________________,
若低于30℃,则_____________________________,为控制此温度范围,采取的加热方法
为_________________。
⑵ 加料完毕后,继续保温30分钟,目的是___________________________________。
静置后只析出NaHCO3晶体的原因是___________________________________。
用蒸馏水洗涤NaHCO3晶体的目的是除去_______________杂质(以化学式表示)
⑶ 过滤所得的母液中含有___________________________(以化学式表示),需加入_______,
并作进一步处理,使NaCl溶液循环使用,同时可回收NH4Cl
⑷ 测试纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品W g,放入锥形瓶中加蒸馏水
溶解,加1-2滴酚酞指示剂,用物质的量浓度为c( mol/L)的HCl溶液滴定至溶液由
红色到无色(指示CO32-+H+==HCO3-反应的终点),所用HCl溶液的体积为V1 mL,再
加1-2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄变橙,所用HCl溶液总体积
为V2 mL。写出纯碱样品中NaHCO3质量分数的计算式:
NaHCO3% = ______________________________。
35.⑴ ⅠA或第一主族
⑵ 物理变化
⑶ NaCl,58.5
⑷ NaOH+SO3==NaHSO3 , NaHSO3+HCl==NaCl+H2O+SO2 ↑
⑸ C、D
35.(05广东)(8分)海水占地球总储水量的97.2%。若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海洋资源。
(1)海水中含有大量的氯化钠。氯化钠中的金属元素位于元素周期表第 族。
(2)目前国际上实用的“海水淡化”主要技术之一是蒸馏法。蒸馏法是将海水变成蒸汽,蒸汽经过冷却而得高纯度淡水,由此可判断蒸馏法是 (填物理变化、化学变化)
(3)工业上利用电解饱和食盐水可制得重要化工产品,反应式为:
 食盐+H2O
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
食盐+H2O
NaOH+H2+Cl2(未配平)。该反应中食盐的化学式是_______________。利用电解所得气体制36.5%的浓盐酸1000t,最少需要消耗食盐
t。
|
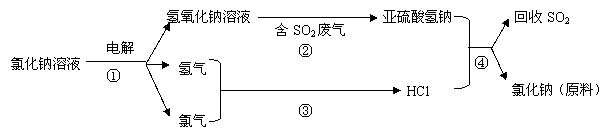
写出②④的化学反应方程式:
⑸ 上述亚硫酸氢钠与甲醛经过一定反应,可以合成俗称“吊白块”(雕白粉)的物质。因吊白块对人体有害,不能用于食品漂白。其结构简式为:HOCH2SO3Na,根据其结构特点,吊白块能发生的反应有:
A.皂化反应 B.聚合反应 C.与金属钠反应 D.氧化反应
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com