
22.(10分)X、Y、Z、W、V为前四周期常见的五种元素,其中有四种为短周期元素,其相关信息如下表:
|
元素 |
相 关 信 息 |
|
X |
X原子核外电子数等于电子层数 |
|
Y |
常温常压下,Y单质固体难溶于水而易溶于CS2 |
|
Z |
Z基态原子的次外层为18个电子,最外层无成对电子 |
|
W |
W的氢化物在水中可完全电离出氢离子 |
|
V |
V原子的电子层数是其价电子数的三倍 |
请回答下列问题:
(1)写出实验室通过加热制备W单质的离子方程式
_____________________________________________________________________
(2)V的两种常见氧化物中阳离子和阴离子个数比为2:1的是:
__________________________________(写化学式)
(3)写出Y单质和Z单质反应的化学方程式
_______________________________________________________________________[来
(4)写出X、Y、V三种元素组成的化合物的水溶液与W单质反应的离子方程式
_____________________________________________________________________
(5)10g Z单质和500mL 1.2mol/L稀硝酸在一定条件下反应,硝酸被还原仅生成一种无毒的气体,Z单质完全溶解。向反应后的溶液中再加入50mL 2.4mol/L的稀硫酸,则所得溶液还能溶解Z单质的质量是_________g。(假定反应条件不变)
21.(11分)某课外活动小组在实验室制备氨气,并进行有关氨气的性质探究。
实验室中可供选择的药品有:
A.生石灰、 B.浓氨水、C. NaOH固体、D.氯化铵、E.硝酸铵
(1)该小组在上述药品中只选择两种合适的试剂制备干燥的氨气。
①应该选用的仪器及装置有(填字母) 。

|
|
|
|
|
|
|
|
|

②所选择的试剂能产生氨气的原因是____________________________________
__________________________________________ 。
(2)该小组同学设计下图所示装置探究氨气的还原性。
|
|
|
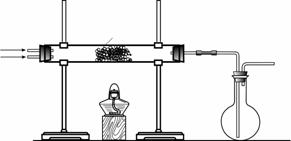
①氨催化氧化的化学方程式为 _____ 。
②若实验时通入氨气的速率过快,在烧瓶中会出现白烟,该物质的化学式为 ___________ 。
(3)该小组同学以氨气和二氧化碳为原料制备高浓度的碳酸氢铵。
①甲同学先将二氧化碳通入水中,充分溶解后,再通入氨气;乙同学先将氨气通入水中,充分溶解后,再通入二氧化碳。你认为哪一位同学的方案合理并说明原因。
②检验产物中有NH4+的方法为 。
20.(13分)锂电池消耗量巨大,对不可再生的金属资源的消耗是相当大的。因此锂离子电池回收具有重要意义,其中需要重点回收的是正极材料,其主要成分为钴酸锂(LiCoO2)、导电乙炔黑(一种炭黑)、铝箔以及有机粘接剂。某回收工艺流程如下:

(1)上述工艺回收到的产物有 _______________________ 。
(2)废旧电池可能由于放电不完全而残留有原子态的锂,为了安全,对拆解环境的要求是____________________________________________________________________。
(3)碱浸时主要反应的离子方程式为__________________________________________。
(4)酸浸时反应的化学方程式为______________________________________________。如果用盐酸代替H2SO4和H2O2的混合液也能达到溶解的目的,但不利之处是______________________________________________________________________。
(5)生成Li2CO3的化学反应方程式为__________________________________________。已知Li2CO3在水中溶解度随着温度升高而减小,最后一步过滤时应______________。
19.(8分)已知Ca(OH)2与Cl2反应的氧化产物与温度有关,在一定量的石灰乳中通入一定量的氯气,二者恰好完全反应(发生的反应均为放热反应)。生成物中含有Cl-、C1-、C1O3-三种含氯元素的离子,其中C1O-、C1O3-两种离子的物质的量(n)与反应时间(t)的曲线如右图所示。
(1)t1时,开始有C1O3-生成的原因是
__________________________________________________
(2)t2时,Ca(OH)2与Cl2发生反应的总的化学方程式为:
。
(3)该石灰乳中含有Ca(OH)2的物质的量是__________ mol
(4)若反应物的量不变,在某条件下恰好完全反应时,氧化产物比值为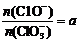 ,则n(C1-)= ___ mol(用含a的代数式来表示)。
,则n(C1-)= ___ mol(用含a的代数式来表示)。
18.44.8g铜跟适量的浓硝酸反应,铜全部作用后,共收集到NO、NO2混合气体22.4L(标准状况),则反应消耗的硝酸的物质的量是 ( )
A.2.0 mol B.2.2mol C.2.4 mol D.2.6 mol
 卷Ⅱ(共56分)
卷Ⅱ(共56分)
17.下列能达到实验目的的是 ( )
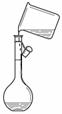
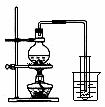
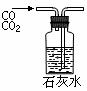

A.吸收HCl制盐酸 B.由海水制取少量蒸馏水
C.转移溶液 D.除去杂质气体CO2
16.氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:3SiO2+6C+2N2 Si3N4+6CO。下列叙述不正确的是 ( )
Si3N4+6CO。下列叙述不正确的是 ( )
A.在氮化硅的合成反应中,N2是还原剂,SiO2是氧化剂
B.上述反应中每生成1molSi3N4,N2得到12mol是电子
C.若已知上述反应为放热反应,升高温度,其平衡常数减小[
D.若使压强增大,上述平衡向逆反应方向移动
15.下列实验现象和原因分析均正确的一项是 ( )
|
选项 |
实验现象 |
原因分析 |
|
A |
SO2通入石蕊试液,石蕊试液褪色 |
SO2具有漂白性,使其褪色 |
|
B |
向稍湿润的蔗糖中加入浓硫酸,固体变黑且体积急剧膨胀 |
浓硫酸具有脱水性,使其变黑、体积膨胀 |
|
C |
向氢硫酸溶液中通入适量SO2,溶液PH变大 |
两者发生中和反应,使c(H+)浓度变小 |
|
D |
向BaCl2溶液中先通入SO2,再通入氨气,产生白色沉淀 |
生成了BaSO3沉淀 |
14.相同状况下,将下列四种混合气体 ①体积比为3 : 1的NH3和N2 ②体积比为 1 : 1的NO2和N2 ③体积比为1 : 1的NO2和O2 ④体积比为3 : 1的NO2和NO,分别置于相同的四支试管中并倒置于水槽中,充分反应后液面上升高度分别为h1、h2、h3、h4,下列关系正确的是 ( )
A.h1>h2>h3>h4 B.h1>h3>h4>h2
C.h4>h1>h3>h2 D.h4>h3>h2>h1
13.下列离子方程式表达正确的是 ( )
A.将氯化亚铁溶液和稀硝酸混合: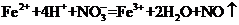
B.用碳酸钠溶液吸收少量二氧化硫: 2CO32-+SO2+H2O ==2HCO3-+SO32-
C.向硫酸铝溶液中加入过量的氢氧化钡溶液:
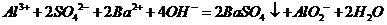
D.酸性KMnO4溶液与H2O2反应,证明H2O2具有还原性:
2MnO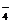 + 6H+
+ 3H2O2 = 2Mn2+ + 4O2↑ + 6H2O
+ 6H+
+ 3H2O2 = 2Mn2+ + 4O2↑ + 6H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com