
9.(广东省佛山市禅城实验高中2009届高三第二次月考)已知铅蓄电池放电时发生如下反应:
负极:Pb+SO42-=PbSO4+2e-
正极:PbO2+4H++SO42-+2e-=PbSO4+2H2O
实验室用铅蓄电池作电源,用惰性电极电解CuSO4溶液,当阴极析出2.4g铜时,铅蓄电池内消耗H2SO4物质的量至少是(A )
A. 0.075mol B. 0.050mol C. 0.20mol D. 0.40mol
8. (广东省佛山市禅城实验高中2009届高三第二次月考)(16分)食盐是日常生活的必需品,也是重要的化工原料。
⑴粗食盐常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液
75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-离子,选出a所代表的试剂,按滴加顺序依次为
 (只填化学式)。
(只填化学式)。
②洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为 (填选项)
 A.蒸馏水 B.75%的乙醇溶液 C.无水乙醇
A.蒸馏水 B.75%的乙醇溶液 C.无水乙醇
⑵用提纯的NaCl配制500mL4.00 mol·L-1NaCl溶液,所用仪器除药匙、玻璃棒外还有 (填仪器名称)。
⑶电解饱和食盐水的装置如图所示,若收集的H2为2L,则同样条件下收集的Cl2 (填“>”、“=”或“<”)2L,原因是 。装置改进后,可用于制备NaOH溶液,若测定溶液中NaOH的浓度,常用的方法为 。
⑷实验室制备H2和Cl2通常采用下列反应:
Zn+H2SO4====ZnSO4+H2↑
MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
据此,从下列所给仪器装置中选择制备并收集H2的装置 (填代号)和制备并收集干燥、纯净Cl2的装置 (填代号)。
可选用制备气体的装置:


答案⑴①BaCl2、NaOH、Na2CO3(错选或多选本小题不得分。NaOH溶液的加入顺序及是否答NaOH不影响得分);
②B (填75%乙醇,不给分);
⑵天平、烧杯、500mL容量瓶(无500mL不给分,“容”写成“溶”不给分)、胶头滴管;
⑶< 电解生成的氯气与电解生成的NaOH发生了反应 酸碱中和滴定;
⑷e d
7. (广东省汕头金山中学2009届高三化学期中考试)如图x、y分别是直流电源的两极,通电后发现a极质量增加,b极有无色无味气体放出,符合这一情况的是:( A)
(广东省汕头金山中学2009届高三化学期中考试)如图x、y分别是直流电源的两极,通电后发现a极质量增加,b极有无色无味气体放出,符合这一情况的是:( A)
|
|
a极 |
b极 |
x电极 |
电解质溶液 |
||
|
A |
锌 |
石墨 |
负极 |
|
||
|
B |
石墨 |
石墨 |
负极 |
NaOH |
||
|
C |
银 |
铁 |
正极 |
AgNO3 |
||
|
D |
铜 |
石墨 |
负极 |
CuCl2 |
6、(11分)盐酸、硫酸和硝酸是中学阶段常见的“三大酸”。请就“三大酸”与金属铜反应的情况,回答下列问题:
(1)我们知道,稀盐酸与铜不反应,但向稀盐酸中加入H2O2后,则可使铜溶解。该反应的化学方程式为 。
某同学未加入氧化剂,而是利用电化学知识设计了一个实验装置,也能使铜溶于稀盐酸。请在方格中画出该装置:

(2)在一定体积的18 mol·L-1的浓硫酸中加入过量的铜片,加热使之反应,被还原的硫酸是0.9mol,则该硫酸的实际体积 (填大于、等于或小于)100mL。
有同学提出:若使剩余的铜片继续溶解,可向其中加入硝酸盐,可行吗? (填“可行”或“不可行”)
(3)将等质量的铜片分别与等体积、过量的浓硝酸和稀硝酸反应,所得到的溶液前者呈绿色,后者呈蓝色,某同学提出可能是Cu2+浓度不同引起的,你同意这种看法吗?(忽略反应前后溶液体积的变化)
(填“同意”或“不同意”),原因是 。
另一同学提出溶液呈“绿色”是溶液中Cu2+与NO2共存的结果,请你设计实验探究此说法正确与否,简述实验方案、实验现象及由此得出的结论:
答案(11分)(1)Cu+H2O2+2HCl = CuCl 2+ 2H2O (2分)
作图:以铜为阳极,以盐酸为电解质溶液的电解池装置。(2分)
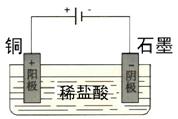

(2)大于(1分);可行(1分)
(3)不同意(1分);等质量的铜片与等体积、过量的浓硝酸、稀硝酸反应,所得溶液中Cu2+的浓度基本相等;(2分)
将一定量的NO2通入铜片与稀硝酸反应后的溶液中,若溶液呈绿色,则该同学的结论正确,反之,不正确。(2分)(其他合理答案也给分)
5、(广东广州花都区2009届高三期初调研试题化学卷) (11分)某同学在探究废干电池内的黑色固体回收利用时,进行如图所示实验:
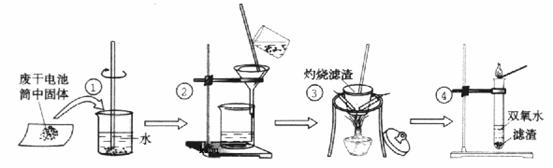
查阅教材可知,普通锌锰电池的黑色物质主要成分为MnO2、NH4Cl、ZnCl2等物质。请回答以下问题:
(1) 操作③灼烧滤渣时所用主要仪器有酒精灯、玻璃棒、 、 ;
(2) 操作④的试管加入③中所得黑色滤渣,试管中迅速产生能使带火星的木条复燃的气
体,据此可初步认定黑色固体为 。
(3) 操作③灼烧滤渣中的黑色固体时,产生一种使澄清石灰水变浑浊的气体,由此推测
滤渣中还存在的物质为 。
(4)该同学要对滤液的成分进行检验,以确认是否含有NH4Cl和ZnCl2,下面是他做完实验后所写的实验报告,请你写出其空白处的内容:
|
实验目的 |
操作 |
实验现象 |
结论 |
|
1、检验Cl- |
取少许滤液于试管中,
|
|
含有Cl- |
|
2、检验NH4+ |
取少许滤液于试管中, |
|
含有NH4+ |
|
3、检验Zn2+ |
取少许滤液于试管中,加入稀氨水 |
先产生白色沉淀,继续加入氨水,沉淀又溶解 |
含有Zn2+ |
(5)根据以上的实验报告,关于滤液的成分,你的结论是:
。
通过一定的操作从滤液中得到固体溶质, 若要将所得固体溶质中的物质加以分离,
可用 法。
答案 (1)坩埚(1分),泥三角(1分) (2)二氧化锰(MnO2)(1分)
(3)C(碳) (1分) (4)(共5分)
|
实验目的 |
操作 |
实验现象 |
结论 |
|
1、检验Cl- |
取少许滤液于试管中, 加入硝酸酸化的硝酸银溶液 (1分) |
有白色沉淀产生 (1分) |
含有Cl- |
|
2、检验NH4+ |
取少许滤液于试管中, 加入浓氢氧化钠溶液并加热,将润湿的红色石蕊试纸置于试管口附近 (2分) |
石蕊试纸变蓝色 (1分) |
含有NH4+ |
(5)滤液中含有氯化铵和氯化锌(1分)。加热(1分)
4、(广东广州花都区2009届高三期初调研试题化学卷)下列关于铜电极的叙述不正确的是(D ) A. 铜锌原电池中铜是正极
B. 用电解法精炼粗铜时粗铜作阳极 C. 在镀件上电镀铜时可用金属铜作阳极 D. 电解稀硫酸制H2、O2时铜作阳极
3、 (广东广州花都区2009届高三期初调研试题化学卷)一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH
+ 3O2 +4OH-
(广东广州花都区2009届高三期初调研试题化学卷)一种甲醇、氧气和强碱溶液做电解质的新型手机电池,可连续使用一个月,其电池反应为:2CH3OH
+ 3O2 +4OH-  2CO32- +6H2O,则有关说法正确的是( B )
2CO32- +6H2O,则有关说法正确的是( B )
A . 放电时CH3OH参与反应的电极为正极
B . 放电时负极的电极反应为CH3OH +8 OH- - 6e- = CO32- + 6H2O
C . 标准状况下,通入5.6LO2并完全反应后,有0.5mol电子转移
D . 放电一段时间后,通入氧气的电极附近溶液的pH降低
2、(广东广州花都区2009届高三期初调研试题化学卷)下列说法正确的是( B )
A.需要加热的化学反应都是吸热反应
B.中和反应都是放热反应
C.原电池是将电能转化为化学能的一种装置
D.水力发电是将化学能转化为电能的过程
1、(广东广州花都区2009届高三期初调研试题化学卷)埋在地下的输油铸铁管道,在下列各种情况下,被腐蚀的速度最慢的是(B )
A.在潮湿疏松透气的土壤中 B.在干燥致密不透气的土壤中
C.在含铁元素较多的酸性土壤中 D.在含碳粒较多,潮湿透气的土壤中
4.将无机物分为氧化物、酸、碱和盐四类,其依据是物质组成和性质上的不同。
氧化物是指由___________种元素组成,且其中一种为__________元素的化合物(注意氧化物与含氧化合物的区别和联系)。 将氧化物分为酸性氧化物、碱性氧化物、两性氧化物、不成盐氧化物,是依据氧化物跟酸或碱反应的情况来区分的。
|
|
酸性氧化物 |
碱性氧化物 |
两性氧化物 |
|
概念 |
|
|
|
|
性质 |
|
|
|
思考:酸性氧化物与非金属氧化物的关系,碱性氧化物与金属氧化物的关系。
酸可以从两个不同的角度进行分类:一是依据酸分子电离生成的H+个数分为一元酸、二元酸、三元酸等;二是依据酸的组成元素中是否含氧元素分为含氧酸和无氧酸。
碱一般根据溶解性可分为可溶性碱和难溶性碱。盐可分为正盐、酸式盐、碱式盐,有关酸、碱、盐的组成及判断见下表:

另外,盐按形成特点可分为四类:
强酸强碱盐:如 特点是 。
强酸弱碱盐:如 特点是 。
弱酸强碱盐:如 特点是 。
弱酸弱碱盐:如 特点是 。
思考:酸、碱、盐、氧化物之间的关系。
试题枚举
[例1]下列叙述正确的是
A.非金属氧化物都是酸性氧化物
B.碱性氧化物都是金属氧化物
C.酸酐都是酸性氧化物
D.酸性氧化物都不能跟酸反应
解析 非金属氧化物不都是酸性氧化物,如水、一氧化碳、一氧化氮等氧化物就属于不成盐氧化物,所以A不正确。酸性氧化物也称为酸酐,但多数有机酸的酸酐却不是酸性氧化物,如乙酸酐的结构简式为:  ,是两分子乙酸脱一分子水的产物,它不属于酸性氧化物。所以C不正确。
,是两分子乙酸脱一分子水的产物,它不属于酸性氧化物。所以C不正确。
酸性氧化物一般不能和酸反应,但二氧化硅能与氢氟酸反应,生成四氟化硅气体和水:
SiO2+4HF=SiF4↑+2H2O
D选项也不正确。只有碱性氧化物都是金属氧化物的说法是正确的。
答案 B
[例2]1995年诺贝尔化学奖授予致力于研究臭氧层破坏问题的三位环境化学家。大气中的臭氧层可滤除大量的紫外光,保护地球上的生物。氟利昂(如CC2F2)可在光的作用下分解,产生Cl原子,Cl原子会对臭氧层产生长久的破坏作用(臭氧的分子式为O3),有关化学反应为:
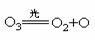 Cl+O3→ClO+O2 ClO+O→Cl+O2
Cl+O3→ClO+O2 ClO+O→Cl+O2
总反应:2O3→3O2
①在上述反应中臭氧变成氧气的反应过程中,Cl是 ( )
A.反应物 B.生成物 C.中间产物 D.催化剂
②在叙述中O3和O2是 ( )
A.同分异构体 B.氧的同位素
C.同系物 D.氧的同素异形体
解析 由题中所给的有关的化学反应可知,在上述反应中,氯原子所起的作用是促进臭氧分子转化成氧气分子,而它本身在反应前后并未发生变化。根据催化剂的概念:能改变其他物质的反应速率而本身的质量和化学性质在反应前后没有改变的物质为催化剂。由此可知Cl的作用是起催化作用,所以Cl为催化剂,在第一问中,D选项为正确答案。O3和O2是由同种元素形成的不同种单质,故D选项为正确答案。
答案 D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com