
1、陈独秀在《新青年》发表文章说:“要巩固共和,非先将国民脑子里所有反对共和的旧思想……洗涮干净不可。”由此反映前期文化运动( )
①为马克思主义在中国的传播做思想准备 ②要在思想上打破封建束缚
③要服务于实现资产阶级民主政治的需要 ④要通过确定共和思想来赢得共和政体
A.①③ B.②④ C.②③④ D.①②③④
21、 (7分)NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
(7分)NaHCO3在潮湿的空气中会缓慢分解,Na2CO3会吸收空气中的水分:Na2CO3+nH2O=Na2CO3·nH2O(n为平均值,n≤10)。取没有妥善保管的NaHCO3样品A9.16g,溶于水配成溶液,慢慢滴入稀盐酸并不停地搅拌,加入盐酸的体积与生成的CO2的体积(标准状况)如下表。(不计溶于水的CO2气体)
|
盐酸体积(mL) |
8 |
15 |
20 |
50 |
x |
120 |
150 |
|
生成CO2体积(mL) |
0 |
112 |
224 |
896 |
2240 |
2240 |
2240 |
试求:
(1)x的最小值为 。
(2)原样品中NaHCO3的质量。(3)样品A中的成分及各成分的物质的量。
20.(15分)为研究温度对Cl2与KOH反应的影响,设计实验如下:
在蒸馏烧瓶中装入足量MnO2,分液漏斗中装足量浓盐酸,大试管A中装4mol/LKOH溶液15mL,并置于75℃水浴中,大试管B中装0.2mol/LKOH溶液,并置于冰水中,C中装NaOH溶液。
试回答下列问题:
(1)水浴加热有什么优点?
(2)如何判断A中已经反应完全?
(3)分离A中生成的两种盐,检测发现其中KCl为0.05mol(不考虑HCl挥发),写出A中发生的化学方程式。
(4)分离B中生成的两种盐,其物质的量之比为1:1,写出离子方程式。
(5)试管B要置于冰水中降温的主要原因是:
A.从试管A中出来的气体温度较高,易使试管B中的溶液温度升高
B.防止生成的盐分解 C.催化剂在冷水中活性最强
D.该反应是放热反应,为防止温度过高,采用降温
(6)图一中,分液漏斗下端连接玻璃管并伸入液面下,其作用是什么?可以用图二代替吗?

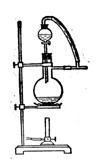


图一 图二
19. (18分)某些物质的转化关系如下图所示。其中甲可由两种单质直接化合得到;乙为金属单质,常温下,它在G的浓溶液中不溶解;F的溶液中只含一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。
(18分)某些物质的转化关系如下图所示。其中甲可由两种单质直接化合得到;乙为金属单质,常温下,它在G的浓溶液中不溶解;F的溶液中只含一种溶质(有的反应可能在水溶液中进行,有的反应的生成物未全部给出,反应条件也未注明)。
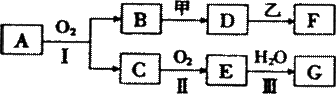
(1) 若用两根玻璃棒分别蘸取A、G的浓溶液并使它们接近时,有大量白烟生成;甲为一种淡黄色固体,D、F的溶液均呈碱性。
① 写出B和甲反应的化学方程式
② 1.7 g A与O2反应生成气态的B和C时放出22.67 kJ热量,写出该反应的热化学方程式:
③ D与乙反应的离子方程式是
(2)若B为红棕色固体,C能使品红试液褪色,D的水溶液中加人HNO3酸化的AgNO3溶液有白色沉淀生成,向F中加入过量的NaOH溶液,有沉淀产生。
① 工业上反应II在 中进行。
② D和乙反应的化学方程式是 。
③ B、D、F中含同一种元素,该元素在周期表中的位置是: 。写出由B为原料,得到该元素单质的化学方程式:
18. (14分)已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的核外电子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:
(1)X、Z二种元素的元素符号:X_________Z__________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子
式分别为__________________、___________________、___________________
(3)由X、Y、Z所形成的常见离子化合物是___________,它与W的最高价氧化
物的水化物的浓溶液加热时反应的离子方程式__________
 (4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是________
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是________
17.(6分)1919年,Langmuir提出等电子原理:原子数相同、电子总数相同的分子,互称为等电子体。等电子体的结构相似、物理性质相近。
(1) 根据上述原理,仅由第2周期元素组成的共价分子中,互为等电子体的是:
 和
;
和
。
和
;
和
。
(2) 此后,等电子原理又有所发展。例如,由短周期元素组成的微粒,只要其原子数相同,各原子最外层电子数之和相同,也可互称为等电子体,它们也具有相似的结构特征。在短周期元素组成的物质中,与NO2-互为等电子体的分子是
A.SO2 B.O3 C.H2S D .SiO2
16.11.6g 加到100mL某浓度的盐酸中,再加入9.8gFe粉,反应停止时,溶液无固体存在,向溶液中滴加KSCN溶液.未见颜色变化,为了中和过量盐酸(不考虑盐酸的挥发),且使铁元素转化为
加到100mL某浓度的盐酸中,再加入9.8gFe粉,反应停止时,溶液无固体存在,向溶液中滴加KSCN溶液.未见颜色变化,为了中和过量盐酸(不考虑盐酸的挥发),且使铁元素转化为 ,共消耗5.0mol/L
,共消耗5.0mol/L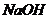 溶液160mL,则原盐酸的物质的量浓度为( )
溶液160mL,则原盐酸的物质的量浓度为( )
A.2.0mol/L B.4.0 mol/L C.6.0 mol/L D.8.0mol/L
15.下列说法中不正确的是( )
A.在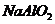 溶液中,
溶液中, 不可能大量存在
不可能大量存在
B.在0.1mol/L的氢溴酸中加人适量蒸馏水,溶液的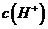 减小
减小
C.常温下,在由水电离出的 mol/L的溶液中,
mol/L的溶液中,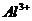 不可能大量存在
不可能大量存在
D.室温下,pH=6的酸性溶液中.可能存在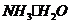 分子
分子
14.将2mol NaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后得到的固体,经测定Na2O2无剩余,则最后固体的物质的量( )
A.1mol~2 mol之间 B.1mol~4mol之间
C.2mol~4mol之间 D.大于4mol
13.实验指出,无水氯化铝在常压条件下不同温度时的密度为:
|
t(℃) |
200 |
600 |
800 |
|
ρ(g/L) |
6.881 |
2.650 |
1.517 |
|
气体摩尔体积(L/mol) |
38.8 |
71.6 |
88.0 |
可见,600℃时无水氯化铝存在形式的化学式为 c
A.AlCl3 B.Al2Cl6 C.AlCl3和Al2Cl6 D.Al3Cl9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com