
5.下列关于图4的各项叙述正确的是D
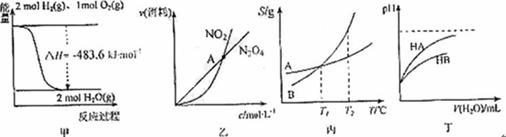
A.甲表示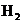 与
与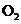 发生反应过程中的能量变化,则
发生反应过程中的能量变化,则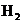 的燃烧热为483.6kJ
的燃烧热为483.6kJ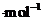
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由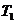 ℃升温至
℃升温至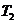 ℃时,溶质的质量分数B>A
℃时,溶质的质量分数B>A
D.丁表示常温下,稀释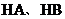 两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的
两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的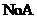 溶液的pH小于
溶液的pH小于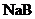 溶液
溶液
4.下列说法正确的是D
A.含有0.5mol 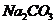 的溶液中溶质的离子总数为1.5×6.02×
1023
的溶液中溶质的离子总数为1.5×6.02×
1023
B.7.8g过氧化钠所含阴离子数为0.2×6.02×1023
C.标准状况下,2.24L乙酸的分子数为0.1×6.02×1023
D.标准状况下,1.12LH2和C12混合气体分子总数为0.05×6.02×1023
3、室温某酸性溶液中只有Na+、CH3COO-、H+、OH-四种离子。下列描述正确的是
A.该溶液由pH=3的CH3COOH与pH=11的NaOH溶液等体积混合而成A
B.该溶液由等物质的量浓度、等体积的NaOH溶液和醋酸溶液混合而成
C.加入适量NaOH,溶液中离子浓度为C(CH3COO-)>C(Na+)>C(OH-)>C(H+)
D.加入适量氨水,C(CH3COO-)一定大于C(Na+)、C(NH4+)之和
2.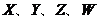 为四种短周期主族元素。其中
为四种短周期主族元素。其中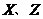 元素原子的电子层数相同,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法一定正确的是C
元素原子的电子层数相同,W与X、Y既不同族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法一定正确的是C
A.Y元素最高价氧化物对应水化物的化学式为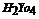
B.原予半径由小到大的顺序为:W<X<Z<Y
C.X与W可以形成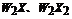 两种氧化物
两种氧化物
D.Y、Z两元素的气态氢化物中,Z的气态氢化物较稳定
1.化学知识广泛应用于生产、生活中,下列叙述正确的是B
A.空气中的臭氧对人体健康有益无害
B.液氯罐泄漏时,可将其移入水塘中并加入生石灰
C.由石英制取单晶硅的过程中,不涉及氧化还原反应
D.棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质
同时本公司为适应不同人群的要求设计了两种类型的“诚信灵”。A.功效在90%以上类,售价为1000元/盒。 B.功效在95%以上类,售5000元/盒。B类产品特别适用于经商者在与对方交谈中希望得到可靠信息时使用。
本产品经过1000多次临床实验,效果十分明显。
本产品无色无味可直接冲水服用,亦可放入其它饮料中使用。
为了确切证明本产品的功效和可信度,减少部分消费者因市场上假冒伪劣产品充斥而对我们有所猜疑的心理,本公司所有成员都已服用过本产品。
本公司所有产品包括该新产品全部由“印度洋保险公司”承担保险。
本公司电话:101--121212,传真:173--181818。
地址:无此县无此村166号。网址:csl.down
本公司欢迎广大消费者以各种形式和我们联系。
订货免费电话:800--810--111111
简评:本文运用反讽手法对虚假产品介绍书的虚伪性进行了讽刺,是曲型的“正话反说”。采用产品说明书的格式,更把假产品广告的虚伪性揭露得深刻、透彻,读后大快人心。全文语言平中见奇,耐人寻味。幽默中见讽剌,诙谐中见批判。
例文3
江苏 考生
姓名:独眼龙
体貌特征:只有一只眼睛,只认人不认事,只要是我的亲信,我就能看见他的优点。
学历:人际关系大学,“任人唯亲”系。曾获国际亲情大赛第一名。
座右铭:不求最好,但求最亲。
偶像:和绅、秦桧等一大批结党营私的高手。
理想:组建一个比欧盟、北约更大的集团,让自己的亲信居要职,共创美好的明天!
对贵公司提出的问题的答复:贵公司中提出宋国富人的例子,让我谈谈看法。我认为这位富人很有发展潜力,他的行为是我学习的榜样。当然是自己的儿子最聪明最可靠嘛!邻家老头与我无亲无故的,怎么可能轻易帮我呢?肯定是贪图我的钱财!哼,他那点伎俩怎能逃过我的独眼金睛呢?
对工作的态度及想法:我对工作的态度是最明确不过的,我不管你做得怎么怎么好,工作成绩如何如何出色,只要你不是我的亲信,达不到我对感情的要求指数,你就休想得到重用。本来嘛,你与我没什么关系,怎么会尽心尽力为我卖力干活呢?做出来的东西肯定只是表面功夫,其实对我不利。
但如果你是我的亲戚,或者我们关系很好,那可就不同了。你肯定对我忠心耿耿,不遗余力地干活。哪怕做得不太好,我心里也比较踏实。
如果贵公司能给我这个机会,我一定为您效犬马之劳,对工作只认人不认事,坚决反对以成绩取人。
社会实践经历:我曾经在一家珠宝行干过营业员。这里的老板也和我一样任人唯亲,我就是慕名而去的。有一次,店里只有我和老板的侄子,恰巧丢了一条金项链。老板知道后,二话没说,便把我给辞了。他说,我不相信自己的侄子难道要相信非亲非故的独眼龙吗?但我一点也不怨他,反而更崇拜他了!在现在的社会中,这种人越来越多,我真是太高兴了。可偏偏有些人不识时务,说什么要凭真才实学,不能靠感情深浅评判事物……这些人真是冷血,一点也不懂亲情的可贵。此风该刹矣!
此致
敬礼!
独眼龙上
简评:这篇高考作文采用“求职信”的格式,运用正话反说的杂文式手法,辛辣地抨击了一种社会流弊。语言机智、幽默,认识深刻、透彻,巧借“独眼龙”之口,展现了当今社会的种种丑陋现象。这种观察事物的独特视角,来源于平素厚实的生活积淀和对作文规律、技法的掌握。
例文4
湖北 考生
一年一度的高考结束了,但考生们和家长们的心还没有放下来,他们还不放心什么呢?报志愿。
成长大学作为世界上一流的学府, 自然倍受瞩目,成长大学领导经过研究,为了培养新世纪的人才,把原有的系重新分为七个系,即健康系、美貌系、诚信系、机敏系、才学系、金钱系和荣誉系。
招生简章如下:
成长大学招生简章
为了适应社会的发展,为了培养新世纪的人才,为了为人类更好的服务,学校领导决定把原有的系重新组成七个系,望广大考生踊跃报名:
健康系--健康比什么都好;
美貌系--沉鱼落雁,闭月羞花;
诚信系--聪明绝顶,绝顶聪明;
才学系--才高八斗,学富五车;
金钱系--没什么别没钱;
荣誉系--身前身后。名;
本大学网址:成长大学.com
简章登出第一天,成长大学网站的访问量突破一百万,其中金钱系21.5%;美貌系20.8%;健康系17%;荣誉系15%;才学系13.2%;机敏系12.5%;诚信系--0%。
校领导看到以后,慌了,他们想:怎么一个报诚信系的都没有呢?经过商讨,又发了一份招生简章补充说明:
鉴于实际情况,我校经研究,做出以下决定:
对于报诚信系的同学,录取分数可以降低30分,且不需要交纳多余钱款,更由蜚声世界的著名教授任教,成绩前30名减免学费,并给予奖学金。其他系则无此待遇。
第二天,满以为报诚信系会多的。校长接到电话,诚信系仍无人报名,其他系总数已超过五万大关,其中金钱系已超过一百万。
校长放下电话,想了想,又做出决定,决心撤销诚信系,改为六个系,其中将金钱系的录取分数线比其他系提高50分,不够分者差一分须1万元。
成长大学的第二篇补充说明又发出去了……
简评:成长大学所设专业已逾出格,更出人意外的是培养人很重要品质的专业却不叫座,近使校领导两发补充说明。这样的事在生活中并不存在,但每一个细节都来自于生活。作者反话正说,夸张渲染,艺术而又真实地列出了部分青年追求的排名榜,提示了社会上某些学校招生的流弊。
例文1
河北 考生
社会不断发展,人民生活水平不断提高,但令不少父母担心的是自己的孩子是老师所谓的“坏孩子”。具体症状如下:思维活跃,看问题角度怪,立意新,且从不人云亦云,特别崇尚独立思
考。如一学生竟把“冰融化后变成什么”这一如此简单问题的答案写成“春天”,让人匪夷所思。本大学急家长之所急,想家长之所想,开办“坏孩子”大学,确保您的 孩子无论当初多么活跃,必将在毕业后成为人云亦云的顺民,成为适应时代需要的“人才”。
本大学特开办如下专业:
限制思维系。此乃我校热门专业,它会使您 的孩子思维僵化,毫无见解。毕业后可做秘书一类工作。该系教学特点如下:上课老师拼命灌,学生拼命记,作业如山题如海,只能听众老师意见,若有个人见解,即被老师罚站,倒立等等共“刑罚”36种。开始虽苦,日久天长定有飞跃,该系系主任:榆木头。
限制表达系。该系宗旨:纵有万语千言,绝不能吐露半点。该系学生特点:死板沉闷,属于“三棒子打不出一个屁”型。我系曾有一优秀毕业生,入学前风华正茂,时常指点江山,激扬文字,经过在该校的努力学习,终于沉默寡言。具体学习方法来校便知。系主任:哑吧。
此外本学校还有诸如限制运动系、限制交流系等。由于本校业绩突出,被誉为“制造顺民的大工厂”。该校环境死气沉沉,毫无生机,非常适合“坏孩子”学习。
鉴于知识经济的冲击,许多青年人思维异常活跃,以杨志远、李泽楷为榜样,使得学校生源日益减少。我校决定化压力为动力,决定减免部分优秀学生学费,以使本校事业发扬光大。
西谚云:“一千人看《哈姆雷特》,便有一千种不同见解。”在我校统统不适用。丰富多彩的答案在这里变成了固定死板的老师发的讲义。由于思维量大幅减少,必将使你心宽体胖,类似猪圈之中的“猪猡”。
欢迎广大无志青年报名。
报名时间:不限
报名地点:社会市普遍区现实路。
“坏孩子”大学招生办
即 日
简评:“答案是丰富多彩的”话题实质是倡导多角度思维和独立思考。本文作者却独辟蹊径,从反面切入,以介绍学校专业的方式,揭露 “应试教育”观念与体制束缚学生思维发展,禁锢学生个性、创造性等弊端与危害。全篇正话反说,幽默风趣,让读者在笑声中思考真理。
例文2
江苏 考生
本公司一向致力于市场急需产品的开发工作,通过对近两年有关权威市场调查数据报告的研究,我们发现:在高科技迅猛发展的今天,人与人之间的信任越来越少。而其根本原因就是人变得
不诚实了,更直接地说就是变得虚伪了。为了满足广大消费者渴求一个诚实守信社会到来的愿望,本公司竭力推出最新产品“诚信灵”。
2.附加隐含条件的应用规律
(1)溶液无色透明时,则溶液肯定无有色离子。如Cu2+(蓝色)、Fe3+(棕黄色)、Fe2+(浅绿色)、MnO4-(紫红色)等都有颜色,若无色溶液则说明这些离子不存在。
(2)强碱性溶液中肯定不存在与OH-起反应的离子。
(3)强酸性溶液中肯定不存在与H+起反应的离子
(4)与水反应的离子,如O2-、N3-、P3-等在水溶液中不存在。
试题枚举
[例1]下列离子方程式正确的是
A.NaHSO3溶液与NaOH溶液反应:HSO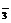 +OH-=SO
+OH-=SO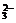 +H2O
+H2O
B.少量二氧化碳通入足量的NaOH溶液:CO2+OH-=HCO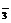
C.Fe与盐酸反应产生H2:2Fe+6H+=2Fe3++3H2↑
D.氨水和醋酸溶液混合NH3·H2O+CH3COOH=NH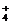 +CH3COO-+H2O
+CH3COO-+H2O
解析: 判断离子方程式的正误应注意①是否符合客观实际;②应该用化学式表示的(气体、沉淀、水、弱酸、弱碱、氧化物、单质等)是否写对,应该删掉的离子是否删去;③是否配平,电子转移是否合理.
据此检查各选项,A、D正确.B错,因少量的CO2通入足量的NaOH溶液中,应生成CO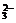 .
.
正确的写法为:CO2+2OH-=CO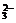 +H2O
+H2O
C错.因不符合客观实际,应生成Fe2+.
正确的写法为:Fe+2H+=Fe2++H2↑
答案: AD
[例2.]下列各组离子中,能在强酸溶液里大量共存,并且溶液呈无色透明的是
A.MnO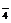 ,K+,Na+,SO
,K+,Na+,SO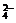 B.Na+,K+,HCO
B.Na+,K+,HCO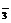 ,Cl-
,Cl-
C.Mg2+,NH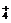 ,Cl-,NO
,Cl-,NO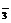 D.Ba2+,K+,S2-,SO
D.Ba2+,K+,S2-,SO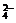
解析:对于离子能否共存问题:必须考虑两个问题,一看同组离子是否发生反应(复分解或氧化还原),二看是否满足题干要求.
有颜色离子:Fe3+,Fe2+,Cu2+,MnO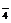 ……
……
强酸性(或强碱性),说明溶液中除离子组内各离子外,还应有H+或(OH-),典型的氧化性离子(如Fe3+,MnO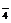 ,Cr2O
,Cr2O 等)和典型的还原性离子(如Fe2+,S2-,I-,SO
等)和典型的还原性离子(如Fe2+,S2-,I-,SO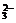 等)在溶液中会发生氧化还原反应.据以上分析得此题正确选项为C.
等)在溶液中会发生氧化还原反应.据以上分析得此题正确选项为C.
答案:C
[例3](1)向NaHSO4溶液中,逐滴加入Ba(OH)2溶液中至中性,请写出发生反应的离子方程式: 。
(2)在以上中性溶液中,继续滴加Ba(OH)2溶液,请写出此步反应的离子方程式 。
解析:题目要求NaHSO4溶液与Ba(OH)2溶液反应呈中性,也即要求写出的离子方程式属于下列反应 2NaHSO4 + Ba(OH)2 = 2H2O + Na2SO4 + BaSO4↓。则离子方程式为:2H+ + SO42- + Ba2+ + 2OH- = BaSO4 ↓ + 2H2O 。若向上述溶液中继续滴加B(OH)2,则有 Ba2+ + SO42- = BaSO4 ↓
答案:2H+ + SO42- + Ba2+ + 2OH- = BaSO4 ↓ + 2H2O
Ba2+ + SO42- = BaSO4 ↓
1.同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子便不能在同一溶液中大量共存.
(1)生成难溶物或微溶物:如Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等不能大量共存。
(2)生成气体或挥发性物质:如NH4+与OH-、H+与CO32-、HCO3-、S2-、HS-、HSO3-、SO32-等不能大量共存。
(3)生成难电离的物质:如H+与CH3COO-、CO32-、S2-、SO32-等生成弱酸;OH-与NH4+、Cu2+、Fe3+等生成弱碱或沉淀;H+与OH-生成水,这些离子不能大量共存。
(4)发生氧化还原反应:氧化性离子(如Fe3+、NO3-、ClO-、MnO4-等)与还原性离子(如S2-、I-、Fe2+、SO32-等)因在溶液中(特别是在酸性溶液中)发生氧化还原反应而不能大量共存。
(5)形成配合物:如Fe3+与SCN-反应生成配合物而不能大量共存。
3.检查离子方程式书写是否正确的几个原则
(1)必须满足三个守恒原则
①元素守恒:反应前后各元素的原子个数相等。
②电荷守恒:方程式左右两边离子的电荷总数相等。
③电子守恒(价守恒):对于氧化还原反应,反应过程中元素化合价升高总数与降低总数相等。
(2)正确把握与“量”有关的反应原则
①某物质若其阴、阳离子都参加了反应,且都反应完全,则方程式中,该物质阴、阳离子个数比应与化学式中组成一致,如Ba(OH)2与H2SO4溶液反应,离子方程式为:
Ba2++2OH-+2H++SO42-═BaSO4↓+2H2O
注意:在H+、OH-、H2O之前的化学计量数2是不可能省去。
②若反应物之间由于量比不同可发生反应时,必须结合量比书写。如Ca(OH)2与NaHCO3反应,有两种情况:
若Ca(OH)2过量:Ca2++OH-+HCO3-═CaCO3↓+H2O
若NaHCO3过量:Ca2++2OH-+2HCO3-═CaCO3↓+2H2O+CO32-
(3)注意反应条件的原则
①溶液酸碱性条件:有些物质在不同条件下存在形态不同,如反应产物有碳酸盐时,则CO32-与HCO3-取决于溶液碱性强弱,强碱溶液中写CO32-,弱碱溶液中(如CO2过量时)写HCO3-。
②温度条件:NH4Cl与NaOH溶液反应时,只有在浓溶液且加热条件下,才可写成NH3↑,否则写成NH3·H2O。
③浓度条件:如BaCl2溶液与稀的NaHCO3溶液不发生反应,而BaCl2溶液与浓的NaHCO3反应,生成BaCO3↓,其离子方程式为:
Ba2++2HCO3-═BaCO3↓+H2O+CO2↑
④注意实验操作条件:如Na2CO3溶液与稀盐酸之间的反应,若将少量的HCl往多量Na2CO3溶液中滴加时:先发生:CO32-+H+═HCO3-;后发生:H++HCO3-═CO2↑+H2O;若将少量Na2CO3往多量HCl中滴加时:CO32-+2H+═CO2↑+H2O。
(4)必须遵循依据客观实验事实的原则
只有电解质参加的且具备电离条件的反应,才可写出离子方程式。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com