
27.A已知C-H,C-F,H-F,F-F键的键焓(△Hb)分别为:414、489、565、158 kJ·mol-1,根据键焓数据估算以下反应的反应热△H:
CH4(g)+4F2(g)﹦CF4(g)+4HF(g)
26.A已知CH3OH(l),HCHO(g)的燃烧焓△H分别为-726.64 kJ·mol-1 和-563.58 kJ·mol-1,求算以下反应的反应热△H:
CH3OH(l)+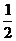 O2(g)﹦HCHO(g)+H2O(l)
O2(g)﹦HCHO(g)+H2O(l)
25.A已知下列热化学方程式:
Fe2O3(s)+3CO2(g)=2Fe(s)+3CO2(g) ; △H1=-25k kJ·mol-1
3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) ; △H2=-47 kJ·mol-1
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ; △H3=19 kJ·mol-1
试计算以下反应的反应热△H:
FeO(s)+CO(g)=Fe(s)+CO2(g)
24.B我国研制的长征捆绑式火箭在第一、二级发动机中用“偏二甲(基)肼”和四氧化二氮作为液体燃料。 (1)已知偏二甲(基)肼的相对分子质量为60,其中含碳40%,含氢13.33%,其余为氮;又知其分子中有一个氮原子不与氢原子相连。通过计算写出偏二甲(基)肼的化学式和分子结构简式: 。 (2)在发动机中偏二甲(基)肼在四氧化二氮中充分燃烧,写出该燃烧反应的化学方程式(反应中所有的氮元素均转化为N2) 。
23.B CO、CH4均为常见的可燃性气体。
(1)等体积的CO和CH4在相同条件下分别完全燃烧,转移的电子数之比是
(2)已知在101 kPa时,CO的燃烧热为283 kJ·mol-1。相同条件下,若2 mol CH4完全燃烧生成液态水,所放出的热量为1 mol CO完全燃烧放出热量的6.30倍,CH4完全燃烧反应的热化学方程式是 。
(3)120℃、101 kPa下,a mL由CO、CH4组成的混合气体在b mL O2中完全燃烧后,恢复到原温度和压强。
① 若混合气体与O2恰好完全反应,产生b mL CO2,则混合气体中CH4的体积分数为 (保留2倍小数)。
② 若燃烧后气体体积缩小了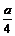 mL,则a与b关系的数学表示式是
。
mL,则a与b关系的数学表示式是
。
20.B磷在氧气中燃烧,可能生成两种固态氧化物。3.1 g的单质磷(P)在3.2 g氧气中燃烧,至反应物耗尽,并放出X kJ热量。
(1)通过计算确定反应产物的组成(用化学式表示)是 ,其相应的质量(g)为 。
(2)已知单质磷的燃烧热为Y kJ·mol-1,则1 mol P与O2反应生成固态P2O3的反应热 ΔH= 。
(3)写出1 mol P与O2反应生成固态P2O3的热化学方程式: 。
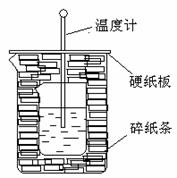 21.B50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在
21.B50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在
如下图所示的装置中进行中和反应。通过测定反应过程
中放出的热量可计算中和热。回答下列问题:
(1)从实验装置上看,图中伤缺少的一种玻璃仪器
是 。
(2)烧杯间填满碎纸条的作用是 。
。
(3)若大烧杯上不盖硬纸板,求得的中和热数值
(填“偏大”“偏小”或“无影响”)。
(4)实验中该用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由:
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;用50mL0.50mol/LNaOH溶液进行上述实验,测得的中和热数值会 (填“偏大”“偏小”或“无影响”)。
22 B通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中 断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si-O |
Si-Cl |
H-H |
H-Cl |
Si-Si |
Si-C |
|
键能/ kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
请回答下列问题:
 ⑴ 比较下列两组物质的熔点高低 (填>或<)
⑴ 比较下列两组物质的熔点高低 (填>或<)
SiC______ Si; SiCl4 ______ SiO2
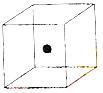
⑵ 右图立方体中心的“●”表示硅晶体中的一个原子,
请在立方体的顶点用“●”表示出与之紧邻的硅原子。
⑶ 工业上高纯硅可通过下列反应制取:
SiCl4 (g) + 2H2(g)  Si(s) +
4HCl(g)
Si(s) +
4HCl(g)
该反应的反应热△H = ___________ kJ·mol-1
19.A已知:① C(s)+O2(g)=CO2(g); DH=-393.5 kJ·mol-1
② 2CO(g)+O2(g)=2CO2(g); DH=-566 kJ·mol-1
③ TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g); DH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的DH= 。
18.A同素异形体相互转化的反应热相当小而且转化速率很慢,有时还很不完全,测定反应热有时很困难,因此常用盖斯定律进行计算得到相应数据。已知:
P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
P(红磷,s)+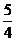 O2(g)=
O2(g)=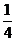 P4O10(s)
△H=-738.5kJ·mol-1
P4O10(s)
△H=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为____________________。
16.A家用液化气的主要成分之一是丁烷,当10kg丁烷完全燃烧并生成二氧化碳和液态水时,放出热量为5×105kJ,试写出丁烷燃烧的热化学方程式________________________,已知1mol液态水气化时需要吸收44kJ的热量,则反应
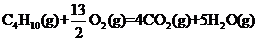 的ΔH为____________________。
的ΔH为____________________。
17A由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。若1g水蒸气转化成液态水放热2.444kJ,则反应H2(g)+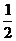 O2(g)
O2(g) H2O(1)的△H= kJ·mol-1。氢气的燃烧热为 kJ·mol-1。
H2O(1)的△H= kJ·mol-1。氢气的燃烧热为 kJ·mol-1。
15.B能源可划分为一级能源和二级能源。自然界中以现成形式提供的能源称为一级能源;需依靠其它能源的能量间接制取的能源称为二级能源。氢气是一种高效而没有污染的二级能源,它可以由自然界中大量存在的水来制取: 2H2O(l)=2H2(g)+O2(g);ΔH=517.6 kJ·mol-1
(1)下列叙述正确的是 ( ) A.电能是二级能源
B.水力是二级能源 C.天然气是一级能源
D.水煤气是一级能源
(2)关于用水制取二级能源氢气,以下研究方向不正确的是 ( )
A.构成水的氢是可以燃烧的物质,因此可研究在水不分解的情况下,使氢成为二级能源 B.设法将太阳光聚集,产生高温,使水分解产生氢气 C.寻找高效催化剂,使水分解产生氢气,同时释放能量 D.寻找特殊化学物质,用于开发廉价能源,以分解水制取氢气
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com