
5.下列关于物质分类的正确组合是: ( )

解析:A组中Na2CO3是盐,SiO2是酸性氧化物;B组中CO不是酸性氧化物;C组中Na2O2不是碱性氧化物;D组分类正确。
答案:D
4.(2008·江苏淮安高三月考)某化学兴趣小组在家中进行化学实验,按照图甲连 接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,下列由此得出的结论正确的是
接好线路发现灯泡不亮,按照图乙连接好线路发现灯泡亮,下列由此得出的结论正确的是  ( )
( )

A.NaCl是非电解质
B.NaCl溶液是电解质
C.NaCl在水溶液中电离出了可以自由移动的离子
D.NaCl溶液中水电离出大量的离子
解析:选项A、B的说法错误;无法通过甲、乙两个装置的实验来断定乙装置能够产生离子的数量大小,故D项错误。
答案:C
3.(200 8·青岛高三模
8·青岛高三模 拟)下列叙述中正确的是 ( )
拟)下列叙述中正确的是 ( )
A.混合物中元素一定呈化合态
B.由一种元素组成的物质一定是单质
C.某纯净的物质不是化合物就是单质
D.由同种分子组成的物质一定是纯净物
解析:混合物中的各种成分既可以是单质,也可以是化合物,故A错误;同种元素可以组成多种单质,由同一种元素组成的不同单质混合在一起即成为混合物,故B错误;纯净的物质不一定是纯净物,如广告 中常说纯净的天然矿泉水,实际上属于混合物,故C错误;而由同种分子组成,也就是由同种物质组成的物质,必定是纯净物。
中常说纯净的天然矿泉水,实际上属于混合物,故C错误;而由同种分子组成,也就是由同种物质组成的物质,必定是纯净物。
答案:D
2.(2008·山东安丘高三月考)分类法是学习和研究化学的一种常用的科学方法。下列分类合理的是 ( )
( )
①根据酸分子中含有的H原子的个数将酸分为一元酸、二元酸等
②根据反应中是否有电子的转移将化学反应分为氧化还原反应和非氧化还原反应
③根据电解质在熔融状态下能否完全电离将电解质分为强电解质和弱电解质
④根据元素原子最外层电子数目将元素分为金属和非金属
⑤根据反应的热效应将化学反应分为放热反应和吸热反应
A.②③ B.②⑤
C.①②④ D.②③④⑤
解析:酸分子中氢原子个数不是划分“几元酸”的标准,如醋酸分 子中含有4个氢原子,但醋酸是一元酸;强弱电解质的划分标准是在水溶液中能否完全电离;最外层电子数相同的碳和铅,碳属于非金属,而铅属于金属。
子中含有4个氢原子,但醋酸是一元酸;强弱电解质的划分标准是在水溶液中能否完全电离;最外层电子数相同的碳和铅,碳属于非金属,而铅属于金属。
答案:B
1.(2009·山东省东营市胜利一中第一学期高三期中考试)下列关于化学学习和研究的说法错误的是 ( )
A.化学模型有助于解释一些化学现象
B.质量守恒定律是大量试验事实的总结
C.化学家提出的假设都能被试验证明
D.化学基本原理的应用是有一定条件的
答案:C
4.检验步骤
①在待测溶液中加入 ,排除 等离子的干扰。注意一般不用稀HNO3,因为稀HNO3能将 氧化成 而被漏检。
②在排除干扰后的溶液中加入 ,产生的白色沉淀一定是BaSO4,则此溶液中一定含有SO42-。
|
[特别提醒]:检验SO42-的关键是既要注意试剂的选择,又要注意操作顺序的优化,方能排除干扰离子的误导,要全面考虑,综合分析,正确推导。 |
[例4]对某酸性溶液(可能含有Br-、SO42-、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色 ②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝 ③加入氯水时,溶液略显黄色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。对于下列物质不能确认其在溶液中是否存在的是 ( )
A.Br- B.SO42- C.H2SO3 D.NH4+
[解析]①加热时放出的气体可以使品红褪色,则溶液中一定含有H2SO3,因H2SO3不稳定,分解产生的SO2可使品红褪色。②加碱后加热,产生使润湿的红色石蕊试纸变蓝的气体,即有NH3产生,说明溶液中一定含有NH4+。③加氯水时溶液显黄色,说明原溶液中含有Br-。再加BaCl2有白色不溶于HNO3的沉淀生成,说明此时溶液中含SO42-,但可能是原溶液含有的,也可能是氯水氧化H2SO3产生的,故不能确定的为SO42-。
[答案]B
[误区警示]SO42-检验的误区:
①只加可溶性钡盐,不酸化。误将CO32-、PO43-、SO32-、Ag+等干扰离子判成SO42-,此时上述离子同样会产生BaCO3、Ba3(PO4)2、BaSO3、AgCl的白色沉淀。
②误将Ag+、Pb2+判成SO42-。如向待测液中滴加BaCl2溶液,再加盐酸有白色沉淀便断定含SO42-。其错误是未注意溶液中不含SO42-而含Ag+或Pb2+也会有同样现象。
因为Ag++Cl-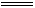 AgCl↓(白色)
Pb2++2Cl-
AgCl↓(白色)
Pb2++2Cl-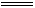 PbCl2↓(白色)
PbCl2↓(白色)
③误将SO32-判成SO42-。如向待测液中滴加用盐酸酸化的Ba(NO3)2溶液生成白色沉淀,便误以为有SO42-。该错误是未注意NO3-具有强氧化性,在酸性环境中发生反应:Ba2++
SO32-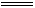 BaSO3↓(白色),3BaSO3+2H++2NO3-
BaSO3↓(白色),3BaSO3+2H++2NO3-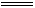 3BaSO4↓(白色)+2NO↑+H2O
3BaSO4↓(白色)+2NO↑+H2O
再如向待测液中滴加用硝酸酸化的BaCl2溶液产生白色沉淀便错误认定一定含SO42-,也同样是落入干扰离子转化为SO42-从而生成BaSO4的陷阱中。
3.检验的误区
干扰检验的离子:Ag+能与SO42-离子反应生成难溶于水的白色沉淀Ag 2SO4;Ag+还能与Cl-反应生成难溶于水的白色沉淀AgCl;SO32-、CO32-、SiO32-、PO43-等能与Ba2+反应生成难溶于水的白色沉淀。但这些白色沉淀溶于强酸中。
2.试剂: 。
1.原理:利用Ba2++SO42-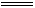 BaSO4↓(白色),BaSO4 盐酸、硝酸的特性。
BaSO4↓(白色),BaSO4 盐酸、硝酸的特性。
2.化学性质
相同点:都是 氧化物。
①都能和水反应,生成的酸 稳定,只能存在于溶液中CO2+H2O H2CO3;
H2CO3;
SO2+H2O H2SO3。
H2SO3。
②都能与碱反应,用量比不同,可以生成两种盐。
SO2、CO2气体通入澄清石灰水中,都是先生成沉淀,当SO2、CO2过量时又溶解。
Ca(OH)2+SO2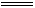 CaSO3+SO2+H2O
CaSO3+SO2+H2O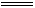
Ca(OH)2+CO2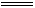 CaCO3+CO2+H2O
CaCO3+CO2+H2O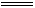
不同点:
①SO2常表现 性:2SO2+O2 2SO3 CO2表现 性:CO2+C
2SO3 CO2表现 性:CO2+C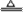 2CO
2CO
SO2被高锰酸钾、氯水、溴水、碘水等氧化剂氧化,CO2不能。
②SO2具有漂白性,能漂白某些有色物质,CO2不能。
③造成环境破坏的原因不同:SO2形成 ,CO2引起 。
|
[特别提醒]:①能使品红溶液腿色的物质有:SO2
、Cl2、O3、H2O2、Na2O2、活性碳等。 ②SO2使氯水、溴水、酸性KMnO4溶液腿色,不是由于其漂白性,而是因为其还原性。③干燥的SO2气体无漂白作用。④等物质的量SO2 和Cl2混合后通入品红溶液中,不能使之腿色。原因是SO2 和Cl2发生反应生成了无漂白性的盐酸和硫酸。 |
[例2] 下列实验能证明某无色气体为SO2的是 ( )
①能使澄清石灰水变浑浊 ②能使湿润的蓝色石蕊试纸变红 ③能使品红试液褪色,加热后又显红色 ④能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀产生
A.①②③④ B.①③④ C.③④ D.②③④
[解析]能使澄清石灰水变浑浊的气体有SO2、CO2;能使湿润的蓝色石蕊试纸变红的气体为酸性气体(如:HCl、HBr、SO2、CO2等);能使品红褪色的气体有Cl2、SO2,但Cl2有颜色,褪色后加热又显红色的只有SO2;能使溴水褪色,再滴加酸化的BaCl2溶液有白色沉淀生成,只有SO2气体符合。
[答案]C
[规律总结] SO2和CO2都能使澄清的石灰水变浑浊,若通入的气体过量,则沉淀都可消失。所以不能用澄清的石灰水鉴别SO2和CO2。通常可用以下方法:
①用品红溶液,使品红溶液褪色的是SO2,不能使品红溶液褪色的是CO2。
②用氢硫酸,出现浑浊的是SO2,无明显现象的是CO2。2H2S+SO2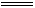 2H2O+3S↓
2H2O+3S↓
③用高锰酸钾溶液,紫色褪去的是SO2,无明显现象的是CO2。
2KMnO4+5SO2+2H2O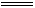 K2SO4+2MnSO4+2H2SO4
K2SO4+2MnSO4+2H2SO4
④用溴水,使橙色褪去的是SO2,无明显现象的是CO2。Br2+2H2O+SO2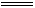 2HBr+H2SO4
2HBr+H2SO4
⑤用硝酸酸化的硝酸钡溶液,产生白色沉淀的是SO2,无明显现象的是CO2。
2H2O+2HNO3+3SO2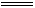 3H2SO4+2NO Ba(NO3)2+H2SO4
3H2SO4+2NO Ba(NO3)2+H2SO4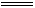 BaSO4↓+2HNO3
BaSO4↓+2HNO3
⑥用FeCl3溶液,使棕黄色颜色变浅的是SO2,无明显现象的是CO2。
2FeCl3+SO2+2H2O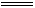 FeCl2+FeSO4+4HCl
FeCl2+FeSO4+4HCl
考点3 浓硫酸和稀硫酸氧化性比较
|
比较项目 |
浓硫酸 |
稀硫酸 |
|
氧化性强弱 |
氧化性(S) |
氧化性(H+) |
|
氧化性的原因 |
|
|
|
还原产物 |
一般是 ,可以是硫单质 |
H2 |
|
与金属单质的反应 |
在常温下,使铁、铝钝化,因加热条件下可以反应。规律:金属+H2SO4→ |
能与排在金属活动顺序表氢之前的金属发生置换反应。 |
|
与非金属单质的反应 |
加热条件下可以和某些非金属单质反应 |
不能反应 |
|
与H2S等还原性物质反应 |
能够反应 |
不能反应 |
|
[特别提醒]:①硫酸的性质取决于硫酸的浓度。②98.3%的浓H2SO4密度为1.84 g·cm-3,比水的密度大;硫酸的浓度越大,密度越大,如将50%的H2SO4溶液和10%的H2SO4溶液等体积混合,则所得溶液的质量分数大于30%;浓H2SO4或密度小于浓硫酸的溶液被稀释或与浓H2SO4混合时,都是将浓H2SO4沿玻璃棒注入其中,并不断搅拌,使其散热。 |
[例3](2008届创博智典联考题)中学教材高中化学第一册有如下图1所示的铜与浓硫酸反应实验装置,该实验过程中会有二氧化硫气体放出,污染室内空气,严重地损害师生健康.为此某课外小组对此实验进行如图2所示的改进,改进的实验操作简单现象明显,并且几乎无二氧化硫气体泄漏。实验步骤如下:


图1 图2
①首先按装置图安装仪器,安装仪器时,在支管胶塞的铁丝构上挂一片品红试纸。
②向试管中加入约10毫升的浓硫酸,加热(在加热浓硫酸时,将铜片向上提起,铜片先不要伸入浓硫酸中),当加热至沸腾时,把铜片放下,使其完全浸入浓硫酸中,反应即刻发生。等不需要反应时停止加热并将铜片提起,离开浓硫酸,反应就停止了。
回答下列问题:
(1)如图2所示,铜片与沸腾的浓硫酸接触后可看到的现象有: ;
(2)塑料袋作用是: ;
(3)为了防止反应结束后留在试管中的气体和塑料袋中的气体污染环境,可进行的操作是: ;相关的离子方程式是: 。
[解析]当铜片接触热浓硫酸时,有大量的白雾产生(白雾是由于二氧化硫气体与水结合形成亚硫酸小液滴缘故)并沿支管口喷在品红试纸上,使品红试纸的红色开始褪色,而且原来无色硫酸溶液开始变绿,当品红试纸完全褪成白色后,把铜片向上提使其离开浓硫酸溶液,反应马上停止。
[答案](1)支管口有白雾,试管中出现绿色,品红试纸褪色,铜片部分溶解。
(2)收集多余的SO2气体,防止污染空气;
(3)在反应后的试管中、塑料袋中加适量的碱吸收SO2气体
SO2+2OH-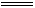 H2O+SO32-或SO2+OH-
H2O+SO32-或SO2+OH-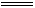 HSO3-
HSO3-
[规律总结]浓硫酸的吸水性:吸收物质中由水分子组成的的水蒸气或结晶水。可用作干燥剂,但一般不能干燥碱性和还原性气体。脱水性:将某些化合物中(主要是有机化合物)中H、O两原子按水的组成比2∶1脱去。(浓硫酸可用作有机反应的催化剂和脱水剂)
浓硫酸使湿润的石蕊试纸先变红(酸性引起),后变黑(脱水性引起);而稀硫酸则只能使湿润的石蕊试纸变红,不能使之变黑或褪色。
考点4 溶液中SO42-的检验
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com