
23.下图是N、O、F三种元素基态原子电子排布的轨道表示式。试回答下列问题:
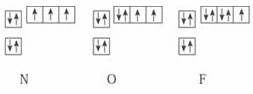
(1)N、O、F形成氢化物的分子组成,与上述基态原子内的电子排布有什么关系?
(2)画出C原子基态原子电子排布的轨道表示式。
(3)根据你发现的规律,对基态C原子形成CH4分子的微观过程提出合理的猜想。
22.下表列出了核电荷数为21~25的元素的最高正化合价,回答下列问题:
|
元素名称 |
钪 |
钛 |
钒 |
铬 |
锰 |
|
元素符号 |
Sc |
Ti |
V |
Cr |
Mn |
|
核电荷数 |
21 |
22 |
23 |
24 |
25 |
|
最高正价 |
+3 |
+4 |
+5 |
+6 |
+7 |
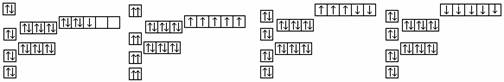
(1)写出下列元素基态原子的核外电子排布式:
Sc____________________________;Ti_______________________________
V ____________________________;Mn ______________________________
(2)对比上述五种元素原子的核外电子排布与元素的最高正化合价,你发现的规律
是_________________________________________________________________________;出现这一现象的原因是_______________________________________________________ 。
21.按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A的原子中只有一个能层且只含1 个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;D的原子第三能层上有8个电子,第四能层上只有1个电子;E原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式(至少写出5个):
(2)写出用上述元素组成的物质制得A的单质的化学方程式(至少写出2个):
;
;
(3)检验某溶液中是否含有D+的离子,可通过______________反应来实现;检验某溶液中是否含有B-的离子,通常所用的试是_________和____
(4)写出E的元素符号_______,要证明太阳上是否含有E元素,可采用的方法是_____________
20.不看元素周期表,填写下表:
|
元素 符号 |
核电荷数 |
基态原子的简 化电子排布式 |
周期表中的位置 |
周期表中的位置与外 围电子层排布的关系 |
||
|
周期 |
族 |
|||||
|
Na |
11 |
|
|
|
|
周 期 数 等 于 电 子 层 数 |
|
Ca |
20 |
|
|
|
||
|
Si |
14 |
|
|
|
||
|
As |
33 |
|
|
|
||
|
Cl |
17 |
|
|
|
||
|
Ti |
22 |
|
|
|
|
|
|
Cr |
24 |
|
|
|
||
|
Mn |
25 |
|
|
|
||
|
Cu |
29 |
|
|
|
|
|
|
Zn |
30 |
|
|
|
19.当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下认识正确的是
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.转化后位于p能级上的两个电子处于同一轨道,且自旋方向相同
D.转化后镁原子与硅原子电子层结构相同,化学性质相似
18.按能量由低到高的顺序排列,正确的一组是
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p
17.4p能级只填充一半电子的原子,其原子序数是
A.15 B.33 C.35 D.51
16.X、Y、Z三种元素的原子,其最外层电子排布为ns1,3s23p1和2s22p4,由这三种元素组成的化合物的化学式可能是
A.X3YZ3 B.X2YZ2 C.XYZ2 D.XYZ3
15. 若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
若某基态原子的外围电子排布为4d15s2,则下列说法正确的是
A.该元素基态原子中共有3个电子 B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子 D.该元素原子M能层共有8个电子
14.已知锰的核电荷数为25,以下是一些同学绘制的基态锰原子核外电子的电子排布图,其中最能准确表示基态锰原子核外电子运动状态的是
A B C D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com