
3. 函数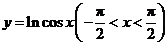 的图象是
的图象是


2. 经过点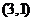 被圆C:
被圆C: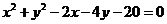 截得的弦最短的直线的方程是
截得的弦最短的直线的方程是
A.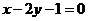 B.
B.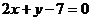 C.
C. D.
D.

1.下面四个条件中,能确定一个平面的条件是
A.空间中任意三点 B.空间两条直线 C.一条直线和一个点 D.两条平行直线
36.(18分)“神舟”六号飞船完成了预定空间科学和技术试验任务后,返回舱于2005年10月17日4时11分开始从太空向地球表面按预定轨道返回。在离地l0km的高度返回舱打开阻力降落伞减速下降,返回舱在这一过程中所受空气阻力与速度的平方成正比,比例系数(空气阻力系数)为k。已知返回舱的总质量M =3000kg,所受空气浮力恒定不变,且认为竖直降落。从某时刻起开始计时,返回舱的运动v - t图象如图中的AD曲线所示,图中AB是曲线在A点的切线,切线交于横轴于B点的坐标为( 10,0 ),CD是AD的渐近线,亦是平行于横轴的直线,交纵轴于C点,C点的坐标为( 0,6 )。请解决下列问题:(取g=10 m/ s2)
(1)在初始时刻v0 = 160m/s时,它的加速度多大?
(2)推证空气阻力系数k的表达式并算出其数值;
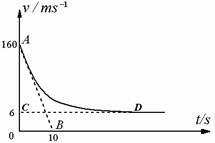 (3)返回舱在距地高度h = 10m时, 飞船底部的4个反推力小火箭点火工作, 使其速度由6m/s迅速减至1m/s后落在地面上。
若忽略燃料质量的减少对返回舱总质量的影响, 并忽略此阶段速度变化而引起空气阻力的变化, 试估算每支小火箭的平均推力(计算结果取两位有效数字)。
(3)返回舱在距地高度h = 10m时, 飞船底部的4个反推力小火箭点火工作, 使其速度由6m/s迅速减至1m/s后落在地面上。
若忽略燃料质量的减少对返回舱总质量的影响, 并忽略此阶段速度变化而引起空气阻力的变化, 试估算每支小火箭的平均推力(计算结果取两位有效数字)。
35.(18分)质量为m的物块用压缩的轻质弹簧卡在竖直放置的矩形匣子中,如图所示,在匣子的顶部和底部都装有压力传感器。当匣子随升降机以a=2.5m/s2的加速度竖直向上做匀减速运动时,匣子顶部的压力传感器显示的压力为6.0N,底部的压力传感器显示的压力为12.0N(取g=10m/s2)。
(1)当升降机匀速运行时,匣子顶部压力传感器的示数为多少?
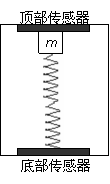 (2)要使匣子顶部压力传感器的示数为零,升降机沿竖直方向的运动情况可能是怎样的?
(2)要使匣子顶部压力传感器的示数为零,升降机沿竖直方向的运动情况可能是怎样的?
36题图
34.(18分)本题包含两小题:
(1)在做“互成角度的两个共点力的合成”的实验中有以下实验步骤,其合理顺序是: 。(用相应字母表示)
A.通过改变两个拉力的大小和方向,从而改变橡皮条的伸长,再重复做几次;
B.只用一个弹簧秤,通过细绳把橡皮条的结点拉到同样的位置O,记下弹簧秤的读数和细绳的方向,按同样比例作出这个力F’的图示;
C.在桌面上放一块方木板,在木板上垫一张白纸,把橡皮条一端固定在木板的 A点;
D.记下两个弹簧秤的读数以及结点的位置,描下两条细绳的方向,在纸上按比例作出力F1和F2的图示,用平行四边形定则求出(作出)合力F;
E.比较力F’与用平行四边形定则求出的力F,看它们在实验误差范围内是否相等;
F.用两条细绳结在橡皮条的另一端(即结点),通过细绳用两个弹簧秤互成角度拉橡皮条,橡皮条伸长,使结点到达某一位置O;
(2)(14分)某实验小组的同学在用打点计时器探究小车的加速度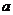 与的质量M之间关系的实验中,不改变拉力T (即牵拉小车的细线所吊挂砂桶与砂的重力mg一定),只改变小车的质量M,得到了如下表所示的几组实验数据。其中第3组数据还未算出加速度,但该组对应的纸带已经打出,如下图所示。打点计时器接的是50Hz的低压交流电源,图中各点为每打5个点标出的计数点,测量长度的单位为cm。
与的质量M之间关系的实验中,不改变拉力T (即牵拉小车的细线所吊挂砂桶与砂的重力mg一定),只改变小车的质量M,得到了如下表所示的几组实验数据。其中第3组数据还未算出加速度,但该组对应的纸带已经打出,如下图所示。打点计时器接的是50Hz的低压交流电源,图中各点为每打5个点标出的计数点,测量长度的单位为cm。
|
实验次数 |
1 |
2 |
3 |
4 |
5 |
6 |
|
小车质量(g) |
200 |
300 |
400 |
500 |
600 |
1000 |
|
小车加速度 (m/s2) |
2.00 |
1.33 |
|
0.79 |
0.67 |
0.40 |
|
小车质量倒数 (kg-1) |
5.00 |
3.33 |
2.50 |
2.00 |
1.67 |
1.00 |
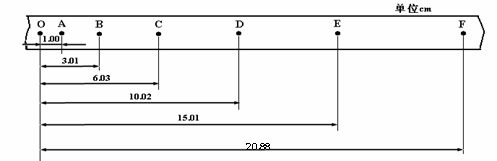
 ① 请由上图中纸带上记录测量的数据,求出该
① 请由上图中纸带上记录测量的数据,求出该
次实验中:C点对应的瞬时速度vC = ___
_____m/s,O点对应的瞬时速度v0 = ______
m/s,以及加速度a =_______m/s2,并填入
上表空缺中;(结果均保留两位有效数字)
② 请在图示的坐标中,恰当选择研究变量,根
据上面表格中对应的各组数据作出能够较直
观反映实验规律的关系图线(用小“×”号
描点,并据此作出平滑的图线);
③ 由②中作出的图象可以得出的结论是:____________________________;
④ 该实验开始进行时,要先_______ _ ____,具体操作方法是:_____________________ ;
⑤ 只有当小车质量M与砂桶及砂的总质量m大小满足___ __时,方可认为细线对小车的拉力T的大小等于悬挂线所吊砂桶与砂的重力mg。
33.(19分)实验室里有一瓶KCl与CaCl2的固体混合物,通过下面实验可确定该混合物中KCl和CaCl2的质量比,也可制得纯净的KCl,根据实验步骤填写下列空白:
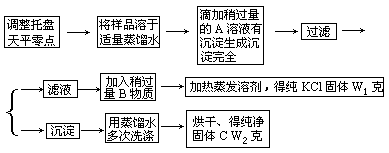
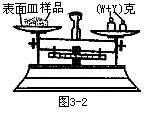 (1) 某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如下图示。请补完整后面的操作是_______。
(1) 某学生用已知质量y克的表面皿,准确称取W克样品,他在托盘天平的右盘放入(W+y)克砝码,在左盘的表面皿中加入样品,这时指针偏向右边,如下图示。请补完整后面的操作是_______。
(2)滤液中加入的B物质是_______,应该加
入过量B物质,理由是_____。
(3)过滤得到沉淀C时,为检验沉淀是否洗净,
应用蒸馏水多次洗涤后,在最后几滴滤出
液中加入______,若______,表示沉淀已洗净。
(4)配制100mL0.20mol·L-1的KCl溶液:某学生用托盘天平将准确称取的(A)1.500gKCl固体放入烧杯中,加入(B)约30mL蒸馏水,用玻璃棒搅拌使其溶解,冷却到室温后,(C)将KCl溶液由烧杯小心倒入100mL容量瓶(不漏液)中,(D)然后往容量瓶中加蒸馏水,直到液面接近标线1-2cm处,摇匀并静置几分钟后,改用胶头滴管加蒸馏水,(E)使溶液凹面最低点恰好与刻度相切,把容量瓶盖盖好,振荡摇匀后装瓶。该学生操作中错误的是_____(填写编号)。
(5)下面哪些操作会导致所配的100mL0.20mol·L-1的KCl溶液浓度降低_________。
(A)容量瓶用蒸馏水洗涤三次直到洗净
(B)称量KCl固体时将砝码放在左盘
(C)未洗涤转移KCl溶液的烧杯
(D)转移KCl溶液时有KCl溶液溅出
(E)定容时仰视刻度线
32.(14分)X、Y、Z三种化合物均由短周期元素组成。已知三种化合物的水溶液的焰色反应均呈黄色,Y和Z均由三种元素组成。请根据题目的要求回答下列问题。
(1)固体化合物X为浅黄色粉末,该化合物中含有化学键为 (填序号)。
A.离子键 B.极性共价键 C.非极性共价键
(2)写出X与二氧化碳反应的化学方程式 。
(3)下表为Y和Z实验的部分内容
|
序号 |
主要实验步骤及实验现象 |
|
① |
在Y的无色溶液中,加入稀硫酸,放置。产生浅黄色沉淀和无色有刺激性气味的气体。该气体可使品红溶液褪色。 |
|
② |
在Z的无色溶液中,滴加的盐酸,开始有白色沉淀,继续滴加盐酸,白色沉淀先增加后消失,然后加入过量的氨水又出现白色沉淀。 |
|
③ |
将实验②最终得到的混合物加热蒸发、灼烧,最终得到固体。 |
写出含0.1 mol Z的溶液与20 mL 5mol/L的盐酸反应的离子方程式:
实验③加热蒸发、灼烧得到的最终产物主要是 和 。
(4)写出Y与稀硫酸反应的离子方程式 。
31.(16分)A、B、C、D、E为短周期元素,A~E原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素。试回答:
(1)B元素在周期表中的位置为___________________________________;
(2)将D的单质投入A2C中,反应后得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为__________________________________________。
(3)经测定,A2C2为二元弱酸,其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___________________________________。过去常用硫酸处理BaO2来制备制备A2C2,写出该反应的离子方程式___________________________;
现在实验室可以将过氧化钠加入到水中来制取A2C2,写出该反应的化学方程式_______________________________________________________________;
(4)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡废印刷电路板既达到了上述目的,又保护了环境,试写出反应的离子方程式______________________________________。
(5)元素D的单质在一定条件下,能与A单质化合生成一种氢化物DA,熔点为800℃。
① DA能与水反应放氢气,反应化学方程式是 。
②若将1mol DA和1 mol E单质混合加入足量的水,生成气体的体积是(标准状况下) L
30.(15分)某待测液可能有Fe2+、Fe3+、Ag+、Ba2+、Al3+、Ca2+、NH4+等离子,进行了下述实验(所加酸、碱、NH3水、Br2水都是过量的)。
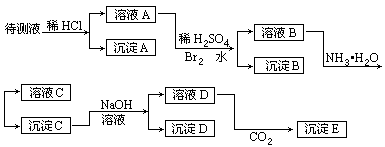
根据实验结果:
(1)判定待测液中有无Ba2+、Ca2+离子,并写出理由。答_________。
(2)写出化学式:沉淀A_________;沉淀D_________;沉淀E_________。
(3)写出下列离子反应方程式:
溴水氧化溶液A中的某离子:_________。
沉淀C加入足量NaOH溶液后其中一种沉淀溶解:_________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com