
8.物体自h高处做自由落体运动的平均速度为10m/s,则h为( )
A.5.0m B.10m C.20m D.25m
7.某物体做自由落体运动,则( )
A.第2s的平均速度为15m/s
B.第7s的位移为65m
C.后一秒的位移总比前一秒的位移多5m
D.前一秒的平均速度总比后一秒的平均速度小10m/s
6.从某一高度相隔1s先后释放两个相同的小球甲和乙,不计空气阻力,它们在空中任一时刻( )
A.甲乙两球距离始终保持不变,甲乙两球速度之差保持不变
B.甲乙两球距离越来越大,甲乙两球速度之差也越来越大
C.甲乙两球距离越来越大,甲乙两球速度之差保持不变
D.甲乙两球距离越来越小,甲乙两球速度之差也越来越小
5.下列说法正确的是( )
A.物体竖直向下的运动就是自由落体运动
B.自由落体运动是初速度为零、加速度为g的竖直向下的匀加速直线运动
C.不同物体的自由落体运动,它们的运动规律是不同的
D.一个质点做自由落体运动,它在第一个2s内,第二个2s内,第三个2s内的位移之比为1:3:5
4.关于重力加速度下面四种说法正确的是( )
A.重力加速度表示自由下落的物体运动的快慢
B.重力加速度表示自由下落物体运动速度变化的大小
C.重力加速度表示自由下落物体运动速度变化的快慢
D.轻、重物体的重力加速度不同
3.自由下落的物体,当它落到全程一半和全程所用的时间之比是( )
A.1:2 B.2:1
C.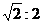 D.
D.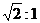
2.在忽略空气阻力的情况下,让一重一轻的两块石头从同一高度同时开始下落,则下述正确的说法是( )
A.重的石块落得快,先着地
B.轻的石块落得快,先着地
C.在着地前的任一时刻,两石块具有相同的速度、相同的位移、相同的加速度
D.两块石头在下落这段时间内的平均速度相等
1.下列说法正确的是( )
A.物体竖直向下的运动是自由落体运动
B.自由落体运动是初速度为零,加速度为g的竖直向下的匀加速运动
C.物体只在重力作用下从静止开始的下落运动叫自由落体运动
D.当空气阻力的作用比较小,可以忽略不计时,物体自由下落可视为自由落体运动
5.浓硝酸和浓盐酸按1:3的 比组成的混合物叫 ,它能溶解惰性金属铂、金,这也是硝酸强氧化性的体现。
此外,硝酸还可以氧化很多还原性化合物,如:S2-、SO32-、I-、Fe2+等
|
特别提醒]:有硝酸参与的氧化还原反应的计算:(1)单质与硝酸的反应,分析讨论是金属还是非金属,若为金属参加的反应硝酸分为两部分,一部分作氧化剂,另一部分起酸性生成硝酸盐,应先确定未被还原的硝酸,再由电子得失守恒求解。若为非金属单质与硝酸反应时,硝酸全部被还原。(2)Cu与HNO3的反应中随着反应的进行浓度逐渐变小,产物由NO2变成NO,最终为混合气体。可以这样理解并分析:反应的硝酸在产物中共三部分: Cu(NO3)2  HNO3- HNO3- 可以看出:被还原的硝酸无论生成NO还是NO2均为一个N原子与一个HNO3的比例关系,即:被还原的硝酸与气体的物质的量相等。而未被还原的硝酸总是生成最高价金属的硝酸盐(如Cu (NO3)2),一个金属离子与金属离子最高价数个HNO3成比例关系,即未被还原的HNO3与金属离子的最高价态数相等。 |
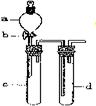 [例3] (2007年重庆)某兴趣小组设计出右图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
[例3] (2007年重庆)某兴趣小组设计出右图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是 。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸。c中反应的化学方程式是
。再由a向c中加2 mL蒸馏水,c中的实验现象是 。
|
方案 |
反应物 |
|
甲 |
Cu、浓HNO3 |
|
乙 |
Cu、稀HNO3 |
|
丙 |
Cu、O2、稀HNO3 |
(3)右表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是 。理由是_____________。
(4)该小组还用上述装置进行实验证明氧化性KMnO4>Cl2>Br2。操作步骤为 ,实验现象为 ;但此实验的不足之处是 。
[解析](1)根据题目的叙述可以知道,这样操作的目的是检验装置的气密性,按题目所述若d试管内有气泡,且冷却后导管中有一段水柱,说明气密性良好。
(2)c中放一小块铜片,由分液漏斗a向c中加入2 mL浓硝酸时发生反应为Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O;若再由a向c中加2 mL蒸馏水,浓硝酸的浓度变小,所以反应变得缓慢、产生的气体颜色变浅。
Cu(NO3)2+2NO2↑+2H2O;若再由a向c中加2 mL蒸馏水,浓硝酸的浓度变小,所以反应变得缓慢、产生的气体颜色变浅。
(3)甲方案制取硝酸铜的反应方程式为Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O,乙方案制取硝酸铜的反应方程式为3Cu+8HNO3(稀)
Cu(NO3)2+2NO2↑+2H2O,乙方案制取硝酸铜的反应方程式为3Cu+8HNO3(稀) 3Cu(NO3)2+2NO↑+4H2O,丙制取硝酸铜的反应方程式为2Cu+O2+2HNO3
3Cu(NO3)2+2NO↑+4H2O,丙制取硝酸铜的反应方程式为2Cu+O2+2HNO3 2Cu(NO3)2。比较这三种方案的化学方程式可以发现均制取1molCu(NO3)2时消耗硝酸的量分别为4mol 、
2Cu(NO3)2。比较这三种方案的化学方程式可以发现均制取1molCu(NO3)2时消耗硝酸的量分别为4mol 、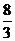 mol 、1mol ,丙方案消耗的硝酸的量最少且不产生污染。
mol 、1mol ,丙方案消耗的硝酸的量最少且不产生污染。
(4)若用上述装置进行实验证明氧化性KMnO4>Cl2>Br2,根据氧化还原反应的规律可以得出应先用KMnO4制Cl2,再用Cl2制Br2。所以实验的操作步骤为向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸;其中实验的现象为c中有黄绿色气体产生,d中溶液变为黄棕色。但是由于Cl2和Br2均为有毒的气体,所以需要尾气处理。
[答案](1)检查装置气密性。
(2)Cu+4HNO3(浓) Cu(NO3)2+2NO2↑+2H2O 反应变缓,气体颜色变淡。
Cu(NO3)2+2NO2↑+2H2O 反应变缓,气体颜色变淡。
(3)丙;耗酸量最少,无污染。
(4)向d中加入KBr溶液,c中加入固体KMnO4,由a向c中加入浓盐酸;c中有黄绿色气体产生,d中溶液变为黄棕色;没有处理尾气。
[规律总结]对铜与硝酸反应实验装置的改进设计有如下的几个要点:①反应开始前装置怎样避免装置内的空气;②怎样使铜与稀硝酸反应能自动停止,防止NO过多;③反应后,能有效的通入空气,证明NO;同时还要防止NO及生成的NO2逸散到空气中。
4.非金属(如碳、硫等)也可以和浓硝酸发生反应,非金属被 ,硝酸完全被还原成 。这和金属与硝酸的反应不同,在有关判断及计算题中应该注意。
C+4HNO3 S+6HNO3(浓)
S+6HNO3(浓)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com