
1、热值:在一定条件下单位质量的物质完全燃烧所放出的热量。
几种燃料的热值:
|
物质 |
天然气 |
石油 |
煤炭 |
氢气 |
甲醇 |
|
热值/Kj ·g-1 |
约56 |
约48 |
约33 |
143 |
23 |
3.热化学方程式:
⑴定义:表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
例如: CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-889.6 kJ/mol
CaCO3(s)=CaO(s)+CO2(g) △H=+178.5 kJ/mol
⑵书写热化学方程式的注意事项:
①反应物和生成物要标明其聚集状态,用g、l、s分别代表气态、液态、固态。
②用△H标明恒压条件下反应放出或吸收的热量,放热为负,吸热为正。
③反应温度、压强不同其△H 也不同,中学阶段指的是标准状况。
④热化学方程式中各物质前的化学计量数不表示分子个数,只表示物质的量,因此可以是整数或分数。
⑤对于相同物质的反应,当化学计量数不同时,其△H 也不同,即△H 的值与计量数成正比。
燃料燃烧释放的热量
2.常见的放热、吸热反应
⑴放热反应:①所有燃烧反应;②酸碱中和反应;③金属与酸生成气体的反应;④大多数的化合反应。
⑵ 吸热反应:
吸热反应:
①C(s) +CO2(g) 2CO(g)
②Ba(OH)2·8H2O(s) + 2NH4Cl(s) = BaCl2(aq) +2NH3(g) + 10H2O(l)
 ③C(s) +H2O(g) CO(g) + H2(g)
③C(s) +H2O(g) CO(g) + H2(g)
④大多数的分解反应
化学反应中的热量变化
1.吸热反应和放热反应
(1)概念
放热反应:有热量放出的化学反应;
吸热反应:吸收热量的化学反应;
(2)分类
 放热反应:放出热量的反应(∑E(反应物)>∑E(生成物))
放热反应:放出热量的反应(∑E(反应物)>∑E(生成物))
化学反应
吸热反应:吸收热量的反应(∑E(反应物)<∑E(生成物))
[图示法表示]
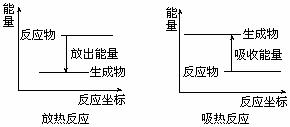
∑E(反应物)>∑E(生成物) ∑E(反应物)<∑E(生成物)
(3)反应中有放热或吸热的原因
从化学键的角度看化学反应中的能量变化
旧键断裂:吸热
新键生成:放热
从反应前后体系的总能量的变化解释
若:H反 > H生,则
若:H反 < H生,则
化学反应过程,是能量的储存与释放的过程
(4)影响反应热大小的因素
①与反应条件(途径)无关--盖斯定律
②与物质的状态有关
③与反应物的用量有关
④相反的过程:△H正= -△H逆
[补充讲解]化学反应遵循着能量守恒定律:反应物的总能量 + 断键时吸收的总能量 = 生成物的总能量 + 成键时放出的能量
从微观角度分析
吸热反应:断开化学键所吸收的能量>形成化学键所放出的能量
放热反应:断开化学键所吸收的能量<形成化学键所放出的能量
2.化学反应限度
(1)概念:当可逆反应的正向反应速率与逆向反应速率相等时,反应物与生成物的浓度就不再改变,我们就说这一反应达到了“限度”。
这种化学反应状态常被称为化学平衡状态,简称“化学平衡”。定义:一定条件下的可逆反应里,正反应速率与逆反应速率相等,反应混合物中各组分的浓度保持不变的状态
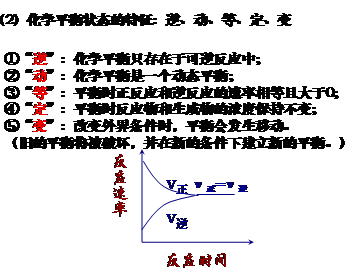
(3)判断依据 (1)V正=V逆
(2)各组分浓度保持不变
[例题解析]:
例1、某温度下将N2和H2充入一恒容的密闭容器中,发生可逆反应:N2
+ 3H2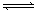 2NH3
2NH3
某一时刻用下列各组内两种物质表示的该反应速率,其中正确的是( )
A.v(N2) = 0.01 mol/(L·s),v(H2) = 0.02 mol/(L·s),
B.v(H2) = 0.02 mol/(L·s),v(NH3) = 1.2 mol/(L·min),
C.v(N2) = 0.01 mol/(L·s),v(NH3) = 1.2 mol/(L·min),
D.v(H2) = 0.06 mol/(L·s),v(NH3) = 0.4 mol/(L·min)
解析:用不同物质表示的化学反应速率之比,等于化学方程式中对应物质的化学计量数之比。
A. v(N2)︰v(H2) = 1︰3,实际上0.01 mol/(L·s)︰0.02 mol/(L·s) = 1︰2;
B. v(H2)︰v(NH3) = 3︰2,实际上0.02 mol/(L·s)︰1.2 mol/(L·min) = 0.02 mol/(L·s) ︰(1.2÷60)mol/(L·s) = 1︰1;
C. v(N2)︰v(NH3) = 1︰2,实际上是1︰2;
D. v(H2)︰v(NH3) = 3︰2,实际上0.06 mol/(L·s)︰0.4 mol/(L·min) = 0.06 mol/(L·s) ︰(0.4÷60)mol/(L·s) =9︰1
应注意化学反应速率的单位:mol/(L·s)和mol/(L·min)之间的转化。
答案 C
例2、下列措施肯定能使化学反应速率增大的是( )
A、增大反应物的量 B、增加压强
C、升高温度 D、使用催化剂
解析:反应物若为固体或纯液体时,增加反应物的量,不影响化学反应速率;若反应物若为固体或纯液体时,增大压强也不影响化学反应速率;温度与压强影响反应速率,而与反应物的状态无关。
答案 C、D
例3、将4 mol A气体和2mol B气体在2L 的密闭容器中混合并在一定条件下发生如下反
应,2A(g) + B(g) = 2C(g),若经2s 后测得C的浓度为0.6mol/L,现有下列几种说法:
①用物质A表示的反应的平均速率为0.3mol/(L•s);②用物质B表示的反应的平均速率为0.6mol/(L•s);③2s时物质A 的转化率为70%;④2s时物质B 的浓度为0.7moL/L
其中正确的是( )
A、①③ B、①④ C、②③ D、③④
解析:反应速率之比等于物质的化学计量数之比,所以v(A)=2v(B)=v(C),
v(C)=0.6mol/L÷2s =0.3mol/(L•s),则v(A)= 0.3mol/(L•s),v(B)= 0.15mol/(L•s)
2s时反应掉A:0.3mol/(L•s)×2s×2L= 1.2mol,A的转化率=1.2moL÷4mol×100%=30%
2s时反应掉B:0.15mol/(L•s)×2s×2L= 0.6mol,所以2s时B的浓度为(2mol-0.6mol)÷2L= 0.7moL/L
答案 B
例4、在一定条件下,某容器中充入N2和H2合成NH3,以下叙述错误的是( )
A.开始反应时,正反应速率最大,逆反应速率为零
B.随着反应的进行,正反应速率逐渐减小,最后减小为零
C.随着反应的进行逆反应速率逐渐增大,最后保持恒定
D.随着反应的进行,正反应速率逐渐减小,最后与逆反应速率相等且都保持恒定
例5、下列对可逆反应的认识正确的是( )
A、SO2+Br2+2H2O=H2SO4+2HBr与2HBr+H2SO4(浓)=Br2+SO2↑+2H2O互为可逆反应
B、既能向正反应方向进行,又能向逆反应方向进行的反应叫可逆反应
C、在同一条件下,同时向正、逆两个方向进行的反应叫可逆反应
D、在一定条件下SO2被氧化成SO3的反应是可逆反应
 例6、下列那种说法可以证明反应:N2+3H2 2NH3已达到平衡状态
( )
例6、下列那种说法可以证明反应:N2+3H2 2NH3已达到平衡状态
( )
A、1个N≡N键断裂的同时,有3个H-H键形成
B、1个N≡N键断裂的同时,有3个H-H键断裂
C、1个N≡N键断裂的同时,有6个N-H键形成
D、1个N≡N键断裂的同时,有6个N-H键断裂
例7、反应4NH3(g)+5O2(g)≒4NO(g)+6H2O(g)在10L密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol,则此反应的平均速率可表示为
Aυ(NH3)=0.010mol·L-1·s-1 Bυ(O2)=0.0010mol·L-1·s-1
Cυ(NO)=0.0010mol·L-1·s-1 Dυ(H2O)=0.045mol·L-1·s-1
解析:υ(H2O)=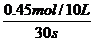 =0.0015mol·L-1·s-1
=0.0015mol·L-1·s-1
υ(NH3)=
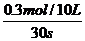 =0.0010mol·L-1·s-1
=0.0010mol·L-1·s-1
υ(O2)= 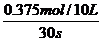 =0.00125mol·L-1·s-1
=0.00125mol·L-1·s-1
υ(NO)= 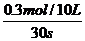 0.0010mol·L-1·s-1
0.0010mol·L-1·s-1
[分析]υ(NH3):υ(O2):υ(NO):υ(H2O)=4:5:4:5
[总结]同一个化学反应中,用不同的物质来表示化学反应的速率,数据不同,但意义相同,同时,速率之比等于化学计量数之比。
例8、反应A+3B≒2C+2D在四种不同情况下的反应速率分别为①υ(A)=0.15mol·L-1·min-1②υ(B)=0.60mol·L-1·min-1③υ(C)=0.40mol·L-1·min-1④υ(D)=0.45mol·L-1·min-1。该反应进行的快慢顺序为________________________
解析:通过数据无法直接比较速率,必须转化为同一物质来表示。①υ(A)=0.15mol·L-1·min-1②υ(B)=0.60mol·L-1·min-1υ(A)=0.20mol·L-1·min-1③υ(C)=0.40mol·L-1·min-1υ(A)=0.20mol·L-1·min-1④υ(D)=0.45mol·L-1·min-1υ(A)=0.225mol·L-1·min-1
④>②=③>①
[总结]比较同一个化学反应在不同条件下的化学反应速率时,应取同一参照物即转化为用同一物质来表示不同条件下的化学反应速率才能比较。
1.可逆反应:在相同的条件下同时向正、逆两个反应方向进行的反应
特征:反应不会进行到底,各物质不为0
4、影响化学反应速率的因素
(1)内因(主要因素)
决定化学反应速率的主要因素是――― 反应物的性质
(2)外因(次要因素)
浓度:当其他条件不变时,增加反应物的浓度,可以增大化学反应速率。此规律适用于溶液或有气体参加的反应。
压强:对于有气体参加的反应来说,当其他条件不变时,增大压强,化学反应速率加快。
说明(1)适用于有气体参加的反应
(2)其它条件不变时,压强增大,
气体物质的浓度增大,化学反应速率加快。
温度:其它条件不变,温度升高,反应速率加快。温度每升高10度,反应速率增大为原来的2-4倍.
催化剂:适当的催化剂能加快化学反应速率
其他因素的影响:反应物的接触面积大小、光、固体反应物颗粒大小、溶剂、超声波、电磁波等

总结:影响化学反应速率的因素:温度、固体表面积、反应物的状态、溶液浓度、催化剂都是影响化学反应速率的因素。
注意:
①对于有固体或纯液体参加的化学反应,改变它们的量不会引起浓度的变化,对它们的反应速率无影响。例如:C(s)+ C02(g)= 2CO(g),增加C的量,对此反应的反应速率无影响。
②压强只对有气体参加或生成的化学反应速率有影响,若一个化学反应中反应物、产物中均无气体,则压强对此反应的反应速率无影响。压强对反应速率的影响关键是看改变压强是否改变相关物质的浓度。对于有气体参加的反应体系,压强的改变实质是气体物质浓度的改变。有以下几种情况: (1)恒温:增加压强→体积减小→浓度增大→反应速率加快 (2)恒容:充入气体反应物→浓度增大→反应速率加快 充入稀有气体→总压增大,但各物质浓度不变→反应速率不变 (3)恒压:充入稀有气体→体积增大→各反应物浓度减小→反应速率减慢 ③多个因素影响反应速率变化要看主要因素
 例如:由图象可知氢气的生成速率随时间先由慢到快,然后又由快到慢。反应体系中硫酸所提供的氢离子浓度是由高到低,若氢气的生成速率由其决定速率的变化趋势也应由快到慢,反应前半程的原因只能是温度所致,锌与硫酸反应时放热,体系温度逐渐升高,温度对反应速率的影响占主导地位,一定时间后,硫酸的浓度下降占据主导地位,因而氢气的生成速率随时间先由慢到快,然后又由快到慢。
例如:由图象可知氢气的生成速率随时间先由慢到快,然后又由快到慢。反应体系中硫酸所提供的氢离子浓度是由高到低,若氢气的生成速率由其决定速率的变化趋势也应由快到慢,反应前半程的原因只能是温度所致,锌与硫酸反应时放热,体系温度逐渐升高,温度对反应速率的影响占主导地位,一定时间后,硫酸的浓度下降占据主导地位,因而氢气的生成速率随时间先由慢到快,然后又由快到慢。
化学反应的限度
3、规律:
(1)V(物质) 该物质不能是纯固体或纯液体
(2)同一反应中,不同物质的V与系数成正比
(3)V为正值,为平均值
注意:同一反应,用不同物质表示的速率虽然数值不同,但其意义相同,都表示化学反应速率的快慢。
2、 反应速率的表示方法:
常依据反应物的消失(单位时间内反应物浓度的减小)或生成物的产生(单位时间内生成物浓度的增大)来表示。
单位:mol/L.min或mol/L.s V=△c/△t
△c :表示物质的量浓度的变化量。
△t:表示时间的变化量
化学反应速率
1、 反应速率的概念:
表示化学反应进行快慢的物理量。(与物理上的速度加以区别)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com