
5、原电池的应用:
4、原电池正负极的判断:
①根据组成原电池两极的电极材料判断:一般是活泼性较强的金属为负极,活泼性较弱的金属或能导电的非金属为正极; ②根据电流方向或电子流动方向判断:电流由正极流向负极,电子由负极流向正极; ③根据原电池里电解质溶液中离子的定向流动方向判断:原电池里电解质溶液中,阳离子向正极移动,阴离子向负极移动; ④根据原电池两极发生的变化来判断:负极总是发生失电子的氧化反应,正极总是发生得电子的还原反应; ⑤根据现象判断:溶解的一极为负极,增重或有气泡产生的一极为正极。
3、构成原电池的条件
原电池形成条件:两极-溶液-导线
(1)有电解质溶液,两种金属中较活动的一种可以在这种电解质溶液中氧化溶解,输送出电子;
(2)有两个活动性不同的金属(一种金属 另一种非金属,或者一种金属和石墨)
具体
①金-------金
②金-------非金属如:石墨
③金-------不溶性的金属氧化物
(3)两电极浸入电解质溶液中且用导线连接或直接接触,两块相连的活泼性不同的金属与电解质溶液接触构成闭合回路。
2、原电池的工作原理
(1)、锌铜原电池:
负极(Zn):Zn-2e-=Zn2+(氧化反应)
正极(Cu):2H++2e-=H2↑(还原反应)
原电池反应:Zn+2H+=Zn2+ H2↑
(2)、反应本质:发生氧化还原反应
(3)、电极名称及判断:
负极:较活泼的金属(失去电子,发生氧化反应)
正极:较不活泼金属或非金属或氧化物(氧化性微粒在此处得电子,发生还原反应)
(4)、电极反应:负极:M-ne→Mn+ 活泼金属失去电子而被氧化腐蚀
正极:酸性溶液2H++2e→H2↑,中性或弱酸性溶液2H2O+O2+4e→4OH-
不活泼金属的盐溶液Mn++ne→M
(5)、电子流向:负极→正极
1、原电池的定义(1):把化学转转化为电能的装置叫原电池
常见原电池:锌锰干电池;铅蓄电池;氢氧燃料电池等;
原电池的定义(2):以氧化还原反应为依据(自发)使氧化反应、还原反应分别在设置的两个电极上进行,从而产生电流的装置叫原电池


化学电池的本质:氧化还原反应。
化学转化为电能
571.6/2)(x) + 2220y = 3847 y = 1.25 mol
V(H2):V(C3H8) =n(H2):n(C3H8) = 3.75:1.25 = 3:1
答案:氢气和丙烷的体积比为 3:1
例8.为什么“用扇子扇炉火,火越烧越旺;吹蜡烛一吹就灭”?
解析:用扇子扇炉火,是以增加空气量为主; 吹蜡烛,主要是空气量太多,带走热量,温度降至着火点以下。过多的空气会带走部分热量,同样造成浪费,因此扇炉火要控制适当。
4、燃烧过程中的热量变化:
(1)放热:形成生成物分子中化学键放出的总能量大于断裂反应物分子中化学键吸收的总能量。
(2)吸热:形成生成物分子中化学键放出的总能量小于断裂反应物分子中化学键吸收的总能量。
Ø 键能越大->化学键越牢固->含该键的分子越稳定
例题解析:
例1.关于吸热反应和放热反应,下列说法中错误的是 ( )
A、需要加热才能进行的化学反应一定是吸热反应
B、化学反应中能量变化,除了热量外,还可以是光能、电能等
C、化学反应过程中的能量变化,也服从能量守恒定律
D、反应物的总能量高于生成物的总能量时,发生放热反应
答案:A
例2.下列热化学方程式书写正确的是( )
A.2SO2+O2 ==== 2SO3 △H=- 196.6 kJ/mol
B.H2(g)+O2(g) === H2O(g) △H=- 241.8 kJ
C.2H2(g)+O2(g) === 2H2O(l) △H=- 571.6 kJ/mol
D.C(s) +O2(g) === CO2(g) △H= + 393.5 kJ/mol
答案:C
例3.下列关于化学反应的说法正确的是( )
A.化学反应的特征是有新物质生成 B.有新物质生成一定是发生了化学变化
C.化学反应的特征是伴随能量的变化 D.化学反应过程中一定有热量释放出来
解析:化学反应的特征不只是有新物质生成,还伴随着能量的变化。A、C都正确。有新物质生成的变化却不一定是化学变化,如原子弹、氢弹的爆炸,原子核裂变和聚变过程中都有新物质生成,B不正确。化学反应有吸热反应和放热反应,D不正确。
答案:AC
例4.某化学反应,设反应物总能量为E1,生成物总能量为E2。
(1)若E1>E2,则该反应为 热反应,该反应的过程可看成是 。
(2)若E1<E2,则该反应为 热反应。那么在发生化学反应时,反应物需要 才能转化成生成物。该反应过程可看成是 。
解析:(1)反应物的总能量大于生成物的总能量,则反应进行的结果必然是部分能量被释放出来。(2)反应物的总能量小于生成物的总能量,则反应进行时必然有外部能量参与到反应中来。
答案:(1)放 “储存”在物质内部的能量转化为热能而被释放出来的过程。
(2)吸 吸收能量 热能转化为物质内部的能量而被“贮存”起来的过程。
例5.250C,1.01×105Pa下,4g CO在氧气中燃烧生成CO2,放出 9. 6kJ热量,写出CO燃烧的热化学方程式。
解析: 设2mol CO 燃烧放出的热量为 Q
2CO + O2 = 2CO2 放热
2×28g Q
4 g 9.6kJ
2×28g : 4g = Q : 9.6 kJ
Q =134.4 kJ
答案:2CO ( 气) + O2 (气) = 2CO2 ( 气 ) ;△H =- 134.4 kJ •mol-
例6.在一定条件下,氢气和甲烷燃烧的化学方程式为:2H2( g ) + O2 ( g ) = 2H2O ( l ) ;△H =- 572 kJ •mol- CH4( g ) +2O2 (g ) = CO2 (g ) +2H2O ( l ) ;△H =- 890 kJ •mol-
由1mol 氢气和3mol甲烷组成的混合气体在上述条件下完全燃烧时放出的热量为多少。
解析:Q = (572kJ ÷ 2) + (890 kJ×3) =2956 kJ
答案:2956 kJ
例7.在一定条件下,氢气和丙烷燃烧的化学方程式为:
2H2( g ) + O2 ( f ) = 2H2O ( l ) ;△H =- 571.6 kJ •mol-C3H8( g ) +5O2 ( g ) = 3CO2 ( g ) +4H2O (l ) ;△H =- 2220 kJ •mol-5mol 氢气和丙烷的混合气完全燃烧时放热3847kJ,则氢气和甲烷的体积比为 (A) 1:3 (B) 3:1 (C) 1:4 (D) 1:1
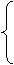 解析:设H2、C3H8的物质的量分别为x,y
解析:设H2、C3H8的物质的量分别为x,y
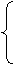 x + y = 5
x = 3.75 mol
x + y = 5
x = 3.75 mol
3、键能:拆开1mol气态物质中某种共价键需要吸收的能量。(某些键的键能)
2、不同燃料热值不同。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com