
概念:生物质能来源于植物及其加工产品贮存的能量。
生物质能特点:
理想的可再生能源
①可再生性
②低污染性
③广泛的分布性
1.直接燃烧:(C6H10O5)n+6nO2 6nCO2+5nH2O
6nCO2+5nH2O
大自然利用太阳能最成功的是植物的光合作用:
|
 C6H12O6+6O2
(2)化学能转化为热能:(C6H10O5)n+nH2O
C6H12O6+6O2
(2)化学能转化为热能:(C6H10O5)n+nH2O nC6H12O6
C6H12O6(s)+6O2(g)→6H2O(l)+6CO2(g) △H=-2804 kJ·mol-1
nC6H12O6
C6H12O6(s)+6O2(g)→6H2O(l)+6CO2(g) △H=-2804 kJ·mol-1
太阳能资源的优点:
(1)、总量最大--取之不尽,用之不竭
(2)、分布最广--遍布世界各地
(3)、最清洁--利用过程中不会产生任何污染,也不会产生废弃物
利用太阳能的一般方式:
(1)光-热转换:利用太阳辐射能加热物体而获得热能。 (2)光-电转换: ①光-热-电转换 ②光-电直接转换 (3)光-化学能转换 (4)光-生物质能转换
太阳能利用技术:
• 主要包括:太阳能热水器、太阳能光伏发电、太阳能建筑、太阳热发电、太阳能空调等。
• 太阳能光伏发电和太阳热发电两项技术在未来的能源产业中至关重要,是目前世界各国关注的热门技术。
太阳能利用中存在的问题:
(1)太阳能吸热板的装置费用昂贵。
(2)太阳能的利用受季节和天气的影响。
(3)大部分太阳能都是在夏天收集。如何把夏天收集的太阳能储存起来,留待冬天使用,仍然是一个有待解决的问题。
要判断电极反应的产物,必须掌握离子的放电顺序。阴离子失去电子而阳离子得到电子的过程叫放电。
阳极产物:应是失电子能力强的优先反应,其失电子能力由大到小的顺序一般为:活泼电极>S2->I->Br->Cl->OH->含氧酸根>F-
阴极产物:直接根据阳离子放电顺序进行判断,阳离子的放电顺序一般为:
Ag+>Fe3+>Cu2+>H+(浓度大时)>Pb2+>Sn2+>Fe2+>Zn2+>H+(浓度小时)>Al3+>Mg2+>Na+>Ca2+>K+
说明:离子放电顺序和离子本性、离子浓度、电极材料、电压等很多因素有关,这里只是一般顺序。
[例题解析]:
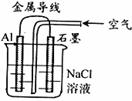 例1 、关于右图装置的叙述,正确的是( )
例1 、关于右图装置的叙述,正确的是( )
A.铝是负极,铝片上析出无色气体。
B.石墨是负极,石墨棒上析出黄绿色气体
C.溶液中两电极间产生白色沉淀。
D.溶液中先产生白色沉淀,最后沉淀溶解。
[解析] Al-空气-电解质溶液形成原电池。铝是负极,Al-3e-=Al3+;石墨为正极,氧气在石墨上放电O2 + 2H2O + 4e-=4OH- 总反应为:4Al +3O2 + 6H2O=4Al(OH)3
 [答案] C
[答案] C
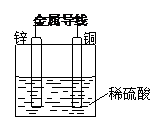
例2、 关于如图所示装置的叙述,正确的是( )
A.铜是负极,铜片上有气泡产生 B.铜片质量逐渐减少
C.电流从锌片经导线流向铜片
D.氢离子在铜片表面被还原
[解析] 锌比铜活泼,所以锌是负极,质量逐渐减少;而铜是正极,氢离子在铜片表面被还原生成氢气。电子从负极经导线流向铜片,电流从铜片经导线流向锌片。选项D符合
例3 、下列装置属于原电池的是 ( )
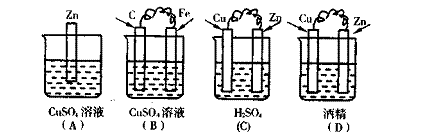
[解析]构成原电池要有四个基本条件:①电解质溶液;②两个电极,其中一个相对较活泼的金属为负极,另一个相对较不活泼的金属或非金属为正极。两个电极直接或间接地连接在一起,并插入电解质溶液中;③能自发地发生氧化还原反应;④形成闭合回路。因此(A)错误,而(D)中,酒精不是电解质溶液,所以正确答案选(B)、(C)。
例4、 2004年美国圣路易斯大学研制了一种新型的乙醇电池,它用磺酸类质子溶剂,在200oC左右时供电,乙醇电池比甲醇电池效率高出32倍且更安全。电池总反应为:C2H5OH +3O2 =2CO2 +3H2O,电池示意如图,下列说法不正确的是
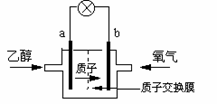
A.a极为电池的负极
B.电池工作时电流由b极沿导线经灯泡再到a极
C.电池正极的电极反应为:4H+ + O2 + 4e- =2H2O
D.电池工作时,1mol乙醇被氧化时就有6mol电子转移
[解析] 根据反应C2H5OH +3O2 ==2CO2 +3H2O,得到C2H5OH被氧化,所以a极为电池的负极;O2被还原,所以b极为电池的正极。电流由b极(正极)沿导线经灯泡再到a极(负极)。电池正极的电极反应为:4H+ + O2 + 4e- =2H2O。电池工作时,1mol乙醇被氧化时应有12mol电子转移。
[答案] D
例5、我国首创以铝–空气–海水电池作为能源的新型海水标志灯,以海水为电解质,靠空气中的氧气使铝不断被氧化而产生电流。只要把灯放入海水中数分钟,就会发出耀眼的白光。试写出电源正负极材料名称、电极反应式。
[解析]负极本身参加反应被氧化,正极必须能导电而本身不参加反应。电源负极材料为:铝;电源正极材料为:石墨等能导电的惰性材料。负极反应为:4Al-12e-=4Al3+;正极反应为:3O2+6H2O+12e-=12OH-。
[答案] 电源负极材料为:铝;电源正极材料为:石墨等能导电的惰性材料。负极反应为:4Al-12e-=4Al3+;正极反应为:3O2+6H2O+12e-=12OH-。
例6、⑴ 美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源。氢氧燃料电池的突出优点是把化学能直接转化为电能,而不经过热能中间形式。电极反应产生的水,经冷凝后又可作为宇航员的饮用水,发生的反应为:2H2+O2====2H2O,则电极反应式分别为:负极 ,正极 。
⑵ 如把KOH改为稀H2SO4作导电物质,则电极反应式为 、 。⑴和⑵的电池液不同,反应进行后,其溶液的pH各有何变化?
⑶ 如把H2改为甲烷,KOH作导电物质,则电极反应式为 、 。如果用稀H2SO4作导电物质,则电极反应式为 、 。
[解析]解决此题的关键是理解原电池的有关概念,注意溶液环境(即酸性、碱性或中性),熟悉原电池电极反应式的一般书写方法。电解质溶液为碱性时,书写电极反应式可出现OH-,但不能出现H+;同样,电解质溶液为酸性时,书写电极反应式可出现H+,但不能出现OH-。
[答案] ⑴ 负极:2H2+4OH--4e-=4H2O,正极:O2+2H2O+4e-=4OH-。
⑵ 负极:2H2-4e-=4H+;正极:O2+4H++4e-=2H2O。
⑶ 负极:CH4+10OH--8e-=CO32-+7H2O;正极:O2+2H2O+ 4e-=4OH-。
负极:CH4+2H2O-8e-=CO2+8H+;正极:O2+4H++ 4e-=2H2O。
例7、据报道,氢燃料电池公交汽车已经驶上北京街头。下列说法正确的 ( )
A.电解水制取氢气是理想而经济的制氢方法
B.发展氢燃料电池汽车不需要安全高效的储氢技术
C.氢燃料电池汽车的使用可以有效减少城市空气污染
D.氢燃料电池把氢气和氧气燃烧放出的热能转化为电能
[解析] 电解水是不经济的制氢方法;发展氢燃料电池汽车需要安全高效的储氢技术;氢燃料电池生成水,无污染;氢燃料电池是把化学能转化为电能。
[答案] C
例8、固体氧化物燃料电池是以固体氧化锆-氧化钇为电解质,这种固体电解质在高温下允许氧离子(O2-)在其间通过,该电池的工作原理如图所示,其中多孔电极a、b均不参与电极反应。下列判断正确的是 ( )
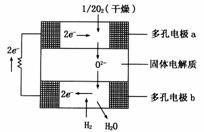
A.有O2参加反应的a极为电池的负极
B.b极的电极反应为:H2 - 2e- + O2- =H2O
C.a极的电极反应为:O2 + 2H2O + 4e- = 4OH-
D.电池的总反应式为:2H2 + O2  2H2O
2H2O
[解析] 这是氢氧燃料电池,O2得电子,H2失电子,所以有O2参加反应的a极为正极,而有H2参加反应的b极为负极。同时要注意电解质在高温下允许氧离子(O2-)在其间通过,
所以正极反应为:O2+4e- = 2O2-;负极反应为H2 - 2e- + O2- =H2O
电池的总反应式为:2H2 + O2
 2H2O
2H2O
[答案] BD
例9、(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼-空气燃料电池放电时:
正极的电极反应式是 。
负极的电极反应式是 。
(3)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
[解析] (1)注意32克N2H4为1mol,注意△H应与方程式的计量数相对应,如N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol
(2)肼-空气燃料电池,电解质溶液是KOH溶液。故电极反应为:(正极)O2+2H2O+4e-=4OH- ,(负极)N2H4+4OH--4e-=4H2O+N2↑
(3)依据氧化还原反应的规律,得到ClO-+2NH3=N2H4+Cl-+H2O
[答案] (1)N2H4(1)+O2(g)=N2(g)+2H2O(1);△H=-624kJ/mol
(2)O2+2H2O+4e-=4OH- ; N2H4+4OH--4e-=4H2O+N2↑
(3)ClO-+2NH3=N2H4+Cl-+H2O
例10、在1L K2SO4和CuSO4混合液中,c(SO42-)=2.0mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到22.4L(标准状况)气体,则原溶液K+的物质的量浓度是
A. 2.0mol/L B. 1.5mol/L C. 1.0mol/L D. 0.5mol/L ( )
[解析]本题主要考查两极电子得失守衡,结合SO42-总量一定进行相关的计算,可确定A选项符合题意。
4、冶炼活泼金属(铝、钠、镁等)
如:2Al2O3=== 4Al + 3O2↑
5、电镀池的形成条件
阴极:待镀金属制品 阳极:镀层金属 电镀液:含有镀层金属阳离子的可溶性盐溶液
3、电镀
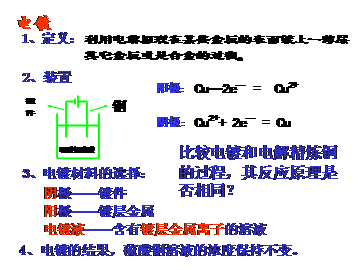
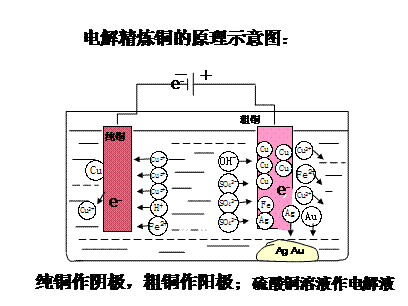

2、铜的电解精炼

1、电解饱和食盐水制取氯气和烧碱(氯碱工业)
9、书写电极反应式
原电池的电极名称一旦确定,则相应电极的电极反应式也随之确定。但书写电极反应式时还需注意以下几点:
① 两极电极反应式中的电子得失数目(一般)保持相等。
② 看负极反应生成的阳离子与电解质溶液中的阴离子能否共存,若不能共存,则该电解质溶液中的阴离子也要写入负极的电极反应式中。如Al-Cu-NaHCO3溶液构成的原电池中,因Al失去电子生成的Al3+能与HCO3-反应:Al3++3HCO3-=Al(OH)3↓+3CO2↑,故铝件(负极)上发生的反应为:Al-3e-+3HCO3-=Al(OH)3↓+3CO2↑,而不是仅仅写为:Al-3e-=Al3+。
③ 当正极上的反应物质为O2时(吸氧腐蚀),要注意电解质溶液的性质。溶液为碱性时,电极反应式中不能出现H+;溶液为酸性时,电极反应式中不能出现OH-。如下面例2。
④ 知道总反应式时,可以先分析此反应中的氧化反应或还原反应(即分析有关元素的化合价变化情况),再写出其离子反应方程式;将各反应式看作数学中的代数式,用总反应式减去较易写出一极(一般为负极)的电极反应式,即得另一极的电极反应式。
⑤ 对于可逆电池反应,需要看清楚“充电、放电”的方向,放电过程是体现原电池原理,充电过程是体现电解池原理。
7、比较:
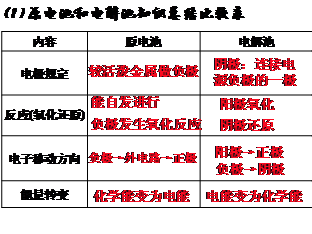
(2)电离和电解
|
|
电 离 |
电 解 |
|
条件 |
电解质溶于水或熔融状态 |
电解质电离后再通直流电 |
|
过程 |
电解质电离为自由移动的离子 CuCl2===Cu2++2Cl- |
阳阴离子得失电子定向移动到两极得失电子形成原子或分子 电解 CuCl2  Cu+Cl2↑
Cu+Cl2↑ |
|
特点 |
只产生自由移动的离子 |
发生氧化还原反应生成新物质 |
|
联系 |
电解建立在电离的基础上 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com