
6. 在密闭容器中进行如下反应:X2(g)+Y2(g)
 2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Y为0.2mol/L B.Y2为0.35mol/L C.X2为0.2mol/L D.
2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下,当反应达到平衡时,各物质的浓度有可能是
A.Y为0.2mol/L B.Y2为0.35mol/L C.X2为0.2mol/L D.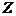 为0.4mol/L
为0.4mol/L
5. 在2A+B=3C+4D反应中,表示该反应速率最快的数据是 A.υA = 0.5mol/(L·s) B.υB = 0.3mol/(L·s) C.υC = 0.8mol/(L·s) D.υD = 1.0mol/(L·s)
4. 下列说法不正确的是 A.任何化学反应都能设计成原电池 B.原电池负极上发生氧化反应 C.化学反应的速率和限度均可通过改变化学反应条件而改变 D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
3. 下列说法错误的是 A.无论固体、液体还是气体的燃烧反应,都是△H<O B.吸热反应的逆反应一定是放热反应 C.碳在完全燃烧时,生成CO2放出的热量比不完全燃烧生成CO放出的热量多 D.选择燃料只要考虑燃料燃烧值的大小就行
2. 已知在相同状况下,要使同一化学键断裂需要吸收的能量等于形成该化学键放出的能量。下列说法正确的是 A.Ba(OH)2·8H2O晶体和NH4Cl晶体的反应是一个放出热量的反应 B.水分解产生氢气和氧气时放出能量 C.相同状况下, 2SO2+O2=2SO3是一个放热反应,则2SO3=2SO2+O2是一个吸热反应 D.73g氯化氢具有的能量大于2g氢气和71g氯气具有的总能量
1. 下列说法正确的是 A.化学反应中的能量变化都表现为热量的变化 B.吸热反应在不加热的条件一定不能发生 C.需要加热才能发生的反应一定是吸热反应,放热反应在常温下一定很容易发生 D.反应是吸热还是放热必须看旧键断裂时吸收的能量和新键生成时释放的能量的大小
3. 请将全部答案填到答题卷中。
可能用到的相对原子质量: H 1 C 12 N 14 O 16 S 32 Zn 65
第Ⅰ卷 (选择题 共60分)
在下列各题的四个选项中均只有一个是符合题目要求的。
2. 考试时间45分钟。
氢能的特点:
(1)、是自然界存在最普遍的元素
(2)、发热值高,本身无毒
(3)、氢燃烧性能好,点燃快
(4)、理想的清洁能源之一
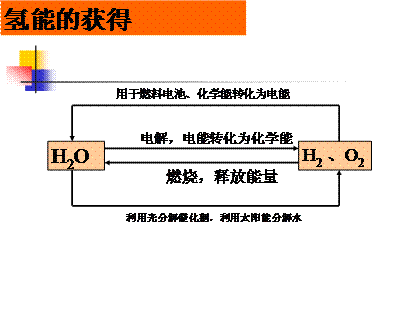
氢能的产生方式:
(1)以天然气、石油和煤为原料,在高温下使之与水蒸气反应而制得。
(2)以天然气、石油和煤为原料,部分氧化法制得。
(3)电解水制得氢气
(4)生物质气化制氢气
(5)光解水制得氢气
氢能的三大优势:
1)、燃烧放出的热量多
2)、燃烧产物是水,不污染环境
3)、制备的原料是水。资源不受限制
氢能的利用途径:
1)、燃烧放热
2)、用于燃料电池,释放电能
3)、利用氢的热核反应释放的核能
化学反应与能量转化 专题检测
说明:
1. 本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分,共100分。
2.生物化学转换
(1)沼气:
(2)乙醇:(C6H10O5)n+nH2O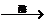 nC6H12O6
C6H12O6
nC6H12O6
C6H12O6 2C2H5OH+2CO2↑
2C2H5OH+2CO2↑
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com