
2.根据物质在同条件下的状态不同.
一般熔、沸点:固>液>气.
如果常温下即为气态或液态的物质,其晶体应属分子晶体(Hg除外).如惰性气体,虽然构成物质的微粒为原子,但应看作为单原子分子.因为相互间的作用为范德华力,而并非共价键.
典型例析
1.由晶体结构来确定.首先分析物质所属的晶体类型,其次抓住决定同一类晶体熔、沸点高
低的决定因素.
① 一般规律:原子晶体>离子晶体>分子晶体
如:SiO2>NaCl>CO2(干冰)
② 同属原子晶体,一般键长越短,键能越大,共价键越牢固,晶体的熔、沸点越高.
如:金刚石>金刚砂>晶体硅
③ 同类型的离子晶体,离子电荷数越大,阴、阳离子核间距越小,则离子键越牢固,晶体的
熔、沸点一般越高.
如:MgO>NaCl
④ 分子组成和结构相似的分子晶体,一般分子量越大,分子间作用力越强,晶体熔、沸点越
高.
如:F2<Cl2<Br2<I2
⑤ 金属晶体:金属原子的价电子数越多,原子半径越小,金属键越强,熔、沸点越高.
如:Na<Mg<Al
5.化学键与分子间力的比较
|
|
概念 |
存在范围 |
强弱比较 |
性质影响 |
|
化学键 |
相邻的两个或多个原子间强烈的相互作用 |
分子内或晶体内 |
键能一般120-800KL/mol |
主要影响分子的化学性质。 |
|
分子间力 |
物质的分子间存在的微弱的相互作用 |
分子间 |
约几个或数十KJ/mol |
主要影响物质的物理性质 |
4.晶体的结构与性质
|
类型 |
离子晶体 |
原子晶体 |
分子晶体 |
|
|
结构 |
构成微粒 |
阴离子、阳离子 |
原子 |
分子 |
|
作用力 |
离子键 |
共价键 |
分子间作用力 |
|
|
性 质 |
硬度 |
较大 |
很大 |
很小 |
|
熔沸点 |
较高 |
很高 |
很低 |
|
|
传导 |
固体不导电,溶化或熔于水后导电 |
一般不导电,有些是半导体。 |
固体不导电,有些溶于水后导电 |
|
|
溶解性 |
易溶于极性溶剂 |
难溶 |
相似相溶 |
|
|
实例 |
盐、强碱等 |
Si、SiO2、SiC |
干冰、纯净磷酸 |
3.极性分子和非极性分子
|
类别 |
结构特点 |
电荷分布特点 |
分子中的键 |
判断要点 |
实例 |
|
非极性分子 |
空间结构特点 |
正负电荷重心重叠,电子分布均匀 |
非极性键极性键 |
空间结构特点 |
H2、CO2、BF3、CCl4、C2H2、C2H4 |
|
极性分子 |
空间结构不对称 |
正负电荷重心不重叠,由于分布不均匀。 |
极性键(可能还含有非极性键) |
空间结构不对称。 |
HCl、H2O、NH3、CH3Cl |
2.共价键
|
定义 |
原子间通过共用电子对所形成的化学键,叫共价键 |
|
|
形成条件 |
一般是非金属元素之间形成共价键,成键原子具有未成对电子 |
|
|
本质 |
成键的两原子核与共用电子对的静电作用. |
|
|
表示方法 |
 1.电子式:H 1.电子式:H 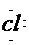 H
H 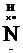  H H |
|
 2.结构式 H-Cl
H 2.结构式 H-Cl
HH-N-H |
||
|
形成过程 |
H×+.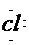  H H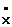 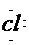 |
|
|
分 类 |
分类依据:共用电子对是否发生偏移 |
|
|
非极性键 |
定义:共用电子对不偏于任何一方 特定:存在于同种原子之间 A-A单质、共价化合物、离子化合物、离子化合物中都可能含有此键。 例:Cl2、H2O2、Na2O2 |
|
|
极性键 |
定义:共用电子对偏向成键原子的一方 特点:存在于不同种原子之间 B-A 共价化合物、离子化合物中都可能含有此键 |
|
|
键 参 数 |
键能 |
折开1mol共价键所吸收的能量或形成1mol共价键所放出的能量,这个键能就 叫键能。 键能越大,键越牢固,分子越稳定。 |
 键长 键长 |
两成键原子核之间的平均距离叫键长。 键越短、键能较大,键越牢固,分子越稳定。 |
|
|
键角 |
分子中相邻的键和键之间的夹角叫键角。它决定分子的空间构型和分子的极性 |
1.化学键、离子键的概念
|
化 学 键 |
定义 |
晶体或分子内直接相邻的两个或多个原子之间的强烈相互作用,通常叫做化学键。 |
|
强烈的体现形式 |
使原子间形成一个整体,彼此不能发生相对移动,只能在一定平衡位置
振动。破坏这种作用需消耗较大能量。 |
|
|
离 子 键 |
定义 |
阴、阳离子间通过静电作用所形成的化学键叫做离子键。 |
|
本质 |
阴阳离子间的静电作用 |
|
|
形成条件和原因 |
稳定的阳离子 活泼金属 M  Mn+ Mn+活泼非金属 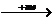 Xm- Xm- 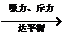 离子键 离子键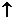 稳定的阴离子 |
|
|
形成过程表示方法 |
mM+nX→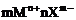 |
|
|
影响强度的因素及对物质性质的影响 |
1.离子半径:离子半径越小,作用越强。含有该键的离子化合物的熔沸点就越高。 2.离子电荷:离子电荷越多,作用越强。含有该键的离子化合物的熔沸点就越高。 |
物质结构的理论是高考的热点之一。要求理解原子的组成和结构,同位素,化学键,键的极性,晶体的类型和性质等。考查主要集中在8电子结构判断,电子式的书写,微粒半径的比较,晶体熔沸点高低判断,化学式的推导及有关晶体模型的计算等,在体现基础知识再现的同时,侧重观察、分析、推理能力的考查。近年来,往往从学科前沿或社会热点立意命题,引导学生关注科技发展,关注社会热点。
2、了解几种晶体类型(离子晶体、原子晶体、分子晶体、金属晶体)及其性质。
1、理解离子键、共价键的含义。理解极性键和非极性键。了解极性分子和非极性分子。了解分子间作用力。初步了解氢键。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com